Microdigest 2
Tour d’horizon du AAIC
Nous résumons ici les principales données publiées lors du CIAA 2024, en nous concentrant sur les nouveaux biomarqueurs et les thérapies anti-amyloïdes.
Plasma Biomarqueurs
Principaux enseignements:
Applications cliniques potentielles :
- Dépistage clinique et sélection des patients pour le traitement.
- Stade de la maladie.
- Suivi de la réponse au traitement.
Considérations :
- L’impact potentiel des comorbidités telles que l’insuffisance rénale chronique.
- L’influence des différences raciales sur les niveaux et les seuils d’utilisation des tests.
- Nécessité de normaliser les tests cliniquement pertinents.
- Quand tester.
Évaluation de l’utilisation prospective des biomarqueurs sanguins de la maladie d’Alzheimer dans les soins primaires et secondaires (Abstract ID : 88404)
Présentateur : Oskar Hansson (Suède)
Biomarqueurs plasmatiques testés :
- Score de probabilité amyloïde (APS)2 : rapport plasma amyloïde-β 42/40 + rapport plasma phosphorylé (p)-tau217/non-tau217.
- Rapport plasmatique p-tau217/non-tau217 seul.
Results:
- Le rapport p-tau217 plasmatique seul avait une précision comparable à celle de l’APS2.
- La précision diagnostique des deux biomarqueurs plasmatiques est de l’ordre de 89 à 92 % dans les établissements de soins primaires et secondaires, dans des analyses prospectives et à lot unique, en utilisant des seuils simples et doubles, et pour la pathologie amyloïde du liquide céphalo-rachidien (LCR) ainsi que pour la maladie d’Alzheimer clinique.
- Les valeurs prédictives positives et négatives respectives (VPP et VPN) étaient comprises entre 86 % et 92 % et entre 90 % et 97 %.
- Les biomarqueurs sanguins ont amélioré de manière significative le bilan diagnostique standard effectué par les médecins de premier recours et les spécialistes de la démence.
- Faibles taux de patients “intermédiaires” sur la base du double seuil de 95 % de spécificité (risque élevé) et de 95 % de sensibilité (risque faible) : 4-13 % pour les soins primaires et 6-11 % pour les soins secondaires.
Utilité des biomarqueurs plasmatiques dans le dépistage de l’amyloïde cérébral au 1Florida Alzheimer Disease Research Center (ADRC) (Abstract ID : 91578)
Présentateur : Ranjan Duara (USA)
- Ethnicité/race des participants : 56 % d’Hispaniques et 96 % de Blancs ; 3 % de Noirs ; 1 % d’autres.
- Biomarqueurs sanguins testés : ratio amyloïde-β 42/40 ; p-tau217 ; protéine acide fibrillaire gliale (GFAP) ; et lumière neurofilamentaire (NfL).
- Une combinaison de biomarqueurs, de génotype APOE et d’atrophie hippocampique a permis de prédire une tomographie par émission de positons (TEP) positive à l’amyloïde avec une “grande précision” dans les modèles de régression logistique, en utilisant les seuils de sensibilité et de spécificité de l’indice de Youden et en tenant compte de l’âge et du sexe.
- Le p-tau217 est le biomarqueur plasmatique le plus performant.
Abréviations : AUC, aire sous la courbe caractéristique du récepteur ; APOE, apolipoprotéine E.
Utilisation du plasma p-tau217 comme méthode de présélection pour détecter la positivité de la TEP amyloïde chez les participants sans troubles cognitifs : Une étude multicentrique (Abstract ID : 85773)
Présentateur : Gemma Salvadό (Suède)
- Seuils : spécificité 90,0 %, 95,0 %, 97,5 %.
- Résultats après ajustement pour l’âge et le statut APOE :
- “Le plasma p-tau217 pourrait être utilisé, soit comme biomarqueur autonome, soit comme étape initiale avant les biomarqueurs du LCR (réduisant leur besoin de ~80-90%), pour la présélection dans les essais cliniques de la MA préclinique en fonction de la certitude nécessaire pour la positivité de l’Aβ-PET”, a déclaré Salvadό.
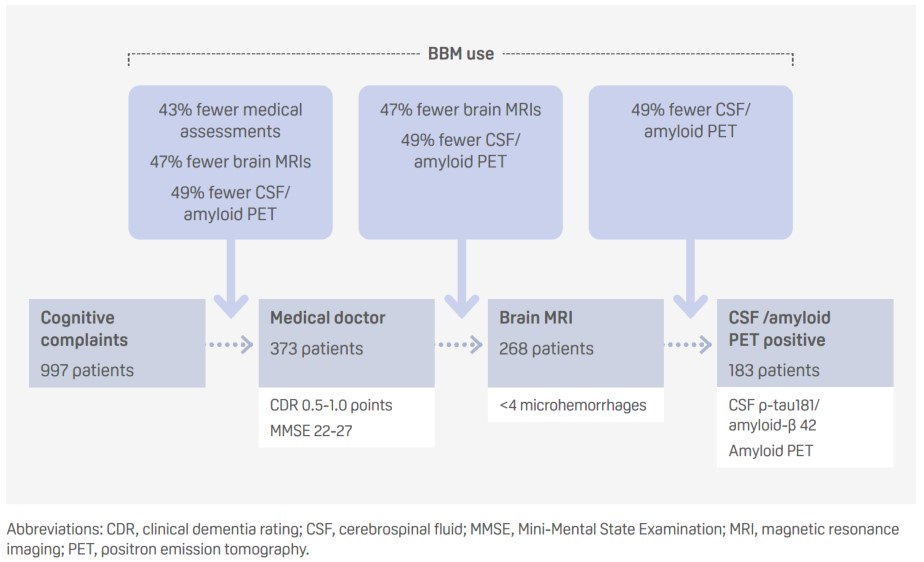
Utilisation d’un panel de biomarqueurs sanguins pour la maladie d’Alzheimer afin de déterminer l’éligibilité à un traitement modificateur de la maladie dans une clinique de la mémoire : trois scénarios (Abstract ID : 91700)
Présentateur : Sinthujah Vigneswaran (Pays-Bas)
- L’utilisation de biomarqueurs sanguins (BBM) à différents stades de la trajectoire diagnostique standard pourrait accroître l’efficacité du processus, en supprimant la nécessité d’effectuer des tests supplémentaires et en réduisant ainsi les coûts.
- Le p-tau217 a détecté la positivité de l’amyloïde, sur la base d’un indice de Youden de 92 % de spécificité, avec une sensibilité de 86 %, une spécificité de 87 %, et des taux de faux positifs et de faux négatifs de 7 % et 32 %, respectivement.
Évaluation de l’interchangeabilité des biomarqueurs sanguins et de la TEP-amyloïde pour l’identification des patients atteints de la maladie d’Alzheimer (Abstract ID : 91465)
Présentateur : Samantha Burnham (USA)
Biomarqueurs plasmatiques testés :
- PrecivityAD®, qui combine les niveaux d’amyloïde-β42/40, l’APOE ε4 et l’âge.
- p-tau217.
Stratification du plasma :
- Amyloïde-β42/40 : absence de plaques amyloïdes, présence de plaques amyloïdes ou intermédiaire.
- p-tau217 : négatif, positif ou indéterminé.
Résultats après exclusion de 14,0 % des patients intermédiaires sur PrecivityAD® et de 18,6 % sur p-tau217 :
| PrecivityAD® | p-tau217 | |
|---|---|---|
| Ruling in patients also amyloid PET visual read positive (PPV) | 86% | 88% |
| Ruling out patients also amyloid PET visual read negative (NPV) | 78% | 92% ↑ |
| Overall percentage agreement with amyloid PET visual read | 81% | 90% ↑ |
- Les deux biomarqueurs plasmatiques ont satisfait aux critères de non-infériorité par rapport à la TEP amyloïde à un seuil de 37 centiloïdes (CL) pour la sélection des patients présentant une pathologie amyloïde.
- “Les résultats soutiennent l’hypothèse selon laquelle les biomarqueurs sanguins peuvent être interchangeables avec les critères de la TEP-amyloïde pour sélectionner les patients qui sont aptes à recevoir un traitement avec de nouvelles thérapies ciblant l’amyloïde et qui en bénéficieraient”, a déclaré M. Burnham.
Tests sanguins de l’amyloïde-bêta 42/40, %p-tau217, 181 et 205 et MTBR-243 pour la maladie d’Alzheimer dans des populations réelles : Résultats de SEABIRD et BioFINDER2 (Abstract ID : 88405)
Présentateur : Randall Bateman (USA)
- La région de liaison des microtubules (MTBR)-tau243 du plasma présente une bonne précision diagnostique pour la positivité de la TEP-Tau et une corrélation robuste avec la TEP-Tau dans les régions de Braak tardives, qui est cohérente chez les patients avec et sans positivité de l’amyloïde-β.
| All participants n=108 | Amyloid-β-positive participants n=51 | |
|---|---|---|
| MTBR-tau243 | 1.00 | 0.98 |
| p-tau217/tau217 ratio | 0.98 | 0.87 |
| p-tau217 concentration | 0.98 | 0.89 |
| All participants n=108 | Amyloid-β-positive participants n=51 | |
|---|---|---|
| Braak I–VI (Global) | 0.87 | 0.86 |
| Braak I–II | 0.89 | 0.54 |
| Braak III–IV | 0.89 | 0.79 |
| Braak V–VI | 0.85 | 0.86 |
AUC : aire sous la courbe caractéristique d’exploitation du récepteur
- La corrélation avec le score du Mini-Mental State Examination (MMSE) s’est avérée similaire pour le MTBR-tau243 et pour la TEP-tau chez tous les patients (Rho=-0,82 vs -0,69) et chez ceux présentant des plaques amyloïdes (Rho=-0,54 vs -0,53).
Évaluation directe des principaux tests sanguins pour la pathologie amyloïde (Abstract ID : 95506)
Présentateur : Kellen Petersen (USA)
Modèles de régression logistique prédisant la précision des biomarqueurs sanguins pour prédire la positivité de la TEP-amyloïde (>20 CL) à l’aide de l’analyse AUC et comparés à l’aide des tests de DeLong.
| Platform | Model | AUC |
|---|---|---|
| C2N Precivity™ | p-tau217 ratio* plus amyloid-β 42/40 | 0.929 ★ |
| p-tau217 ratio | 0.927 | |
| p-tau217 plus amyloid-β 42/40 | 0.921 | |
| p-tau217 | 0.916 | |
| amyloid-β 42/40 | 0.751 | |
| Fujirebio Lumipulse® | p-tau217 plus amyloid-β 42/40 | 0.911 |
| ptau217 | 0.896 | |
| amyloid-β 42/40 | 0.787 | |
| AlzPath Simoa® | p-tau217 | 0.885 |
| Janssen Simoa® | p-tau217 | 0.882 |
| Roche Elecsys® | p-tau181 plus amyloid-β 42/40 plus GFAP plus NfL | 0.677 to 0.873 |
| p-tau181 plus amyloid-β 42/40 plus NfL | 0.677 to 0.873 | |
| p-tau181 plus amyloid-β 42/40 | 0.677 to 0.873 | |
| p-tau181 | 0.677 to 0.873 | |
| amyloid-β 42/40 | 0.677 to 0.873 | |
| GFAP | 0.677 to 0.873 | |
| NfL | 0.677 to 0.873 | |
| Quanterix Simoa® | p-tau181 plus amyloid-β 42/40 plus GFAP plus NfL | 0.670 to 0.808 |
| p-tau181 plus amyloid-β 42/40 plus NfL | 0.670 to 0.808 | |
| p-tau181 plus amyloid-β 42/40 | 0.670 to 0.808 | |
| p-tau181 | 0.670 to 0.808 | |
| amyloid-β 42/40 | 0.670 to 0.808 | |
| GFAP | 0.670 to 0.808 | |
| NfL | 0.670 to 0.808 |
AUC : aire sous la courbe caractéristique du récepteur ; GFAP : protéine acide fibrillaire gliale ; NfL : neurofilament léger
*p-tau217 rapport de p-tau217 à non-p-tau217
Comparaison directe entre le plasma p-tau217 et la tau-PET pour prédire le déclin cognitif futur chez des personnes sans troubles cognitifs (Abstract ID : 90966)
Présentateur : Rik Ossenkoppele (Pays-Bas ; Suède)
Le plasma p-tau217 prédit le déclin cognitif sur le mini mental state examination (MMSE) et le modified Preclinical Alzheimer Cognitive Composite (mPACC).
Meilleurs modèles prédictifs :
- MMSE : p-tau217 plasmatique et absorption tau-PET dans le néocortex temporal (neoT ; mesuré à moins d’un an d’intervalle).
- mPACC : p-tau217 plasmatique et absorption de tau-PET dans le lobe temporal médian (MTL ; mesuré à moins d’un an d’intervalle).
| Cognitive decline on MMSE | Cognitive decline on mPACC | |
|---|---|---|
| Plasma p-tau217 | R2 = 0.14 | R2 = 0.30 |
| MTL tau-PET | R2 = 0.17 | R2 = 0.32 |
| NeoT tau-PET | R2 = 0.21 | R2 = 0.31 |
Biomarqueurs Tau plasmatiques pour la stadification de la maladie d’Alzheimer (Abstract ID : 88408)
Présentateur : Laia Montoliu-Gaya (Suède)
- Modèle de stadification de la maladie en cinq étapes proposé sur la base de la positivité de quatre peptides tau plasmatiques (p-tau217, p-tau205, 0N spécifique au SNC et tau 212-221) après quantification de six peptides tau phosphorylés et de six peptides tau non phosphorylés dans 553 échantillons de plasma provenant de participants à la cohorte BioFINDER-2.
- Le modèle a été comparé à l’état et aux stades de la TEP de l’amyloïde (A) et de la tau (T) dans le lobe temporal médian précoce (MTL) et la région néotemporale intermédiaire (neoT).
| Plasma stage | A/T status | A- T- | A+ T- | A+ T+ | PET stage | MTL+ neoT– | MTL+ neoT+ | MTL+ neoT++ | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Plasma Stage | A/T Status | PET stage | ||||||||||||
| A- T- | A+ T- | A+ T- | MTL+ neoT- | MTL+ neoT+ | MTL+ neoT++ | |||||||||
| Stage 1: negative for all biomarkers | 80.8% | 19.2% | '- | '- | '- | '- | ||||||||
| Stage 2: p-tau217 positive | 3.4% | 40.9% | 55.7% | 22.6% | 22.6% | 31.0% | ||||||||
| Stage 3–4: p-tau217, p-tau205, and 0N CNS-specific positive | '- | '- | 100% | '- | 83.3-86.7% | |||||||||
| Stage 5: p-tau 217, p-tau205, 0N CNS- specific, and tau 212–221 positive | '- | '- | 100% | '- | '- | 100% | ||||||||
- “Nos données soutiennent la notion de stadification de la maladie d’Alzheimer à l’aide de biomarqueurs de fluides”, a déclaré Montoliu-Gaya.
Prédiction des stades pathologiques de l’amyloïde et de la tau basés sur la TEP avec les biomarqueurs plasmatiques dans la maladie d’Alzheimer (Abstract ID : 90581)
Présentateur : Han-Kyeol Kim (République de Corée du Sud)
Le rapport entre le plasma p-tau217 et le plasma non-tau217 était supérieur au p-tau217 et au rapport entre l’amyloïde-β 42 et l’amyloïde-β 40 pour prédire la phase Thal et le stade Braak mesurés à l’aide de la TEP, en particulier dans les stades précoces.
Les AUC pour le rapport p-tau217/non-p-tau217 dans le plasma étaient :
- 0,965 pour prédire la phase I-II de Thal
- 0,848 pour prédire la phase ≥III de Thal
- 0,864 pour prédire Braak I-II
- 0,925 pour prédire Braak III-IV
- 0,889 pour prédire Braak V-VI
Changements entre le milieu et la fin de la vie dans les biomarqueurs sanguins de la pathologie de la maladie d’Alzheimer et de la neurodégénérescence et associations avec le dépôt d’amyloïde dans le cerveau : L’étude ARIC-PET (Abstract ID : 91307)
Présentateur : Priya Palta (USA)
Les biomarqueurs plasmatiques ont été mesurés au milieu de la vie, à un âge moyen de 58,5 ans, ou plus tard, à un âge moyen de 76,2 ans.
Biomarqueurs testés :
- Rapport entre l’amyloïde-β 42 et l’amyloïde-β 40
- Phosphorylé (p)-tau181
- Lumière des neurofilaments (NfL)
- Protéine acide fibrillaire gliale (GFAP)
Biomarqueurs plasmatiques à mi-vie : Aucun des biomarqueurs mesurés au milieu de la vie n’a permis de prédire la positivité de l’amyloïde à la fin de la vie, définie comme un rapport de valeur de captation standardisée du cortex global supérieur à 1,2, une médiane de 19,3 ans plus tard.
Biomarqueurs plasmatiques à un âge avancé : Associations significatives avec la positivité de l’amyloïde à la fin de la vie mesurée par TEP une médiane de 1,6 ans avant la for :
- Rapport amyloïde-β 40/42 : odds ratio=2,12
- p-tau181 : rapport de cotes=1,76
- GFAP : rapport de cotes = 1,72
Thérapies anti-amyloïdes
Principaux enseignements:
- Une durée de dosage limitée est recommandée pour le donanemab au-delà de 12 mois, ce qui est mieux guidé par un PET scan visuellement négatif plutôt que par les niveaux de tau.
- Les données, y compris les données sur les biomarqueurs, soutiennent l’utilisation précoce du lécanemab et le maintien de ses effets bénéfiques pendant 3 ans.
Aperçu de TRAILBLAZER-ALZ 2 (Donanemab) : Traduction clinique potentielle (séance thématique en développement)
Efficacité clinique
Présentateur : Jennifer Zimmer (USA)
- Après 76 semaines, le donanemab avait réduit le risque de progression de la maladie vers le stade suivant de la maladie d’Alzheimer (MA) sur le score global d’évaluation de la démence clinique (CDR-GS ; mesuré tous les 3 mois) d’un pourcentage significatif de 37%.
- Le pourcentage de patients évoluant vers une MA modérée (score CDR-GS ≥2 points) à 76 semaines a été réduit de 50 % de manière significative.
- L’efficacité a été la même pour toutes les populations de tau : le risque de progression de la maladie chez les patients présentant un tau faible à moyen et un tau élevé a été réduit de manière significative de 39 % et de 38 %, respectivement.
- Efficacité constante dans les sous-groupes, y compris les participants hispaniques/latinos.
Risque ARIA gérable
Présentateur : Alessandro Biffi (USA)
- Des anomalies d’imagerie liées à l’amyloïde – œdème/effusions (ARIA-E) ont été observées chez 24 % des patients traités par le donanemab – 18 % asymptomatiques et 6 % symptomatiques.
- Des événements ARIA-E graves sont survenus chez 1,5 % des patients traités par le donanemab, entraînant le décès de trois patients (0,4 %).
- Fréquence la plus élevée d’ARIA-E chez les homozygotes de l’apolipoprotéine (APO)E ε4 (40,6 contre 15,7 % des non-porteurs).
- La plupart des patients n’ont eu qu’un seul épisode d’ARIA-E ; 68 % des patients ont reçu un nouveau dosage, sans récidive dans 70 % des cas.
- Les récidives d’ARIA-E ont tendance à être asymptomatiques et légères à modérées.
- Les principaux facteurs de risque sont les suivants :
- Génotype APOE ε4.
- Nombre de microhémorragies de base.
- Présence de sidérose corticale superficielle au départ.
- Recommandations en matière de gestion des risques :
- Identifier les patients à haut risque avant le traitement.
- Respecter le calendrier de contrôle de l’IRM.
- Titrer, interrompre ou arrêter le traitement selon les besoins.
- Utilisez des corticostéroïdes en cas d’ARIA grave ou symptomatique.
Dosage de durée limitée
Présentateur : Emily Collins (USA)
- Les taux d’amyloïde sont restés faibles chez les patients ayant satisfait aux critères de fin de dose, avec un taux de ré-accumulation de 2,8 centiloïdes (CL) par an.
- Le délai moyen de passage au placebo était de 47 semaines et la différence entre les groupes de traitement a continué à se creuser au-delà de ce délai.
- Deux tiers des patients avaient des niveaux de TEP amyloïde inférieurs à 24,1 CL à 12 mois, ce qui correspondait à un scanner TEP visuellement négatif, qui pourrait être utilisé pour déterminer le moment d’arrêter le traitement.
- Des taux d’amyloïde de base plus faibles permettaient de prédire une réduction plus rapide de la TEP amyloïde en dessous de 24,1 CL.
- La p-tau plasmatique n’était pas suffisamment précise pour déterminer l’élimination de l’amyloïde par le donanemab, car après l’élimination de l’amyloïde, elle reflète toujours la pathologie tau.
Existe-t-il des preuves d’un bénéfice continu pour le traitement à long terme par le lécanemab ? Une mise à jour des bénéfices et des risques à partir des données d’efficacité, de sécurité et de biomarqueurs à long terme (Abstract ID : 92094)
Présentateur : Christopher Van Dyck (USA)
Preuve de la poursuite de l’effet du traitement par lecanemab pendant 3 ans :
- À 36 mois, le changement moyen de l’évaluation de la démence clinique – somme des cases (CDR-SB) par rapport à l’état initial était de 3,09 points, contre un changement moyen de 1,20 point à 18 mois.
- Cela s’est traduit par une différence significative de 0,95 point dans le CDR-SB par rapport aux témoins historiques appariés de l’étude ADNI, une augmentation de la différence de 0,45 point par rapport au placebo à 18 mois, et une réduction de 30 % du risque d’évolution vers le stade suivant de la maladie.
Les groupes à faible taux de tau et d’amyloïde s’en sortent particulièrement bien, ce qui plaide en faveur d’une utilisation précoce du lécanemab :
- Parmi les 58 patients dont la TEP tau était nulle ou faible (SUVR <1,06) au départ, 59 % n’ont pas vu leur score CDR-SB diminuer à 36 mois et 51 % l’ont vu s’améliorer.
- Parmi les 151 patients dont la TEP amyloïde était faible au départ (<60 CL), 46 % n’ont pas vu leur score CDR-SB diminuer et 33 % l’ont vu s’améliorer.
Les données sur les biomarqueurs plasmatiques soutiennent la poursuite de l’utilisation du lécanemab :
- Amélioration de la TEP amyloïde et du rapport amyloïde-β 42/40 plasmatique dans les 3 mois chez les patients commençant le lécanemab à 18 mois.
- La poursuite du traitement est bénéfique de 18 à 36 mois, bien qu’environ 70 % des patients soient négatifs pour l’amyloïde (<30 CL) à 18 mois.
- Les taux plasmatiques de p-tau217 diminuent au cours des 18 premiers mois du traitement par lecanemab, mais augmentent avec le placebo.
- Le taux de MTBR-tau243 dans le LCR a diminué de 44 % après 18 mois de traitement par lecanemab par rapport au placebo.
Faible risque ARIA à long terme
- Le taux d’anomalies d’imagerie liées à l’amyloïde – œdème/effusions (ARIA-E) corrigé de l’exposition était de 6,8 pour 100 personnes-années avec le lécanemab dans l’étude de base et la phase d’extension, contre 9,6 pour 100 personnes-années pour l’étude de base seule.
- L’ARIA-E survient principalement au cours des 6 premiers mois de traitement, après quoi il y a peu de cas et les taux sont similaires à ceux du placebo.
- Les ARIA ne sont pas associées à une accélération de la progression à long terme.
Comment les dernières données de pharmacologie clinique et la modélisation soutiennent-elles la poursuite du dosage du lécanemab ? (Abstract ID : 92091)
Présentateur : Larisa Reyderman (USA)
Étude 201 : 31 patients atteints d’une forme précoce de la maladie d’Alzheimer qui ont arrêté le lecanemab (10 mg/kg toutes les 2 semaines) après 18 mois de traitement, avant de le reprendre en moyenne 2 ans plus tard.
- La double action du lécanemab signifie qu’il n’élimine pas seulement les plaques, mais qu’il cible également les protofibrilles hautement toxiques qui continuent à se former et à provoquer la pathologie de la maladie d’Alzheimer après l’élimination de l’amyloïde.
L’interruption du lecanemab dans l’étude 201 a conduit à.. :
- 21 % de ré-accumulation de PET amyloïde.
- aggravation de 47 % du rapport amyloïde-β 42/40.
- 30% de ré-accumulation de la protéine acide fibrillaire gliale (GFAP).
- 24% de ré-accumulation de p-tau181.
- 13 % de ré-accumulation de p-tau217.
La modélisation pharmacocinétique et pharmacodynamique a montré que la moitié de l’effet thérapeutique du lécanemab est perdue :
- Après 6 mois pour le rapport amyloïde-β 42/40.
- Dans les 12,1 ans pour la TEP amyloïde.
- Dans 1,6 ans pour p-tau181.
- En 1,7 an pour le GFAP.
Une dose d’entretien mensuelle de 10 mg/kg de lécanemab débutée à 18 ou 24 mois est suffisante pour prévenir la ré-accumulation d’amyloïde et l’aggravation des biomarqueurs plasmatiques.
- A eu un effet comparable à une administration bihebdomadaire pendant 4 ans en termes de résultats cliniques mesurés par la TEP amyloïde et le CDR-SB.
Cliquez ci-dessous pour télécharger le Microdigest 2 pdf :
Download Microdigest 2 FR PDFVous pouvez également télécharger le Microdigest d’AD/PD & CONy :
Download Microdigest 1 FR PDF





