Microdigesto 2
Panoramica dell’AAIC
Qui riassumiamo i dati principali rilasciati dall’AAIC 2024, concentrandoci sui nuovi biomarcatori e sulle terapie anti-amiloide.
Plasma Biomarcatori
I punti chiave da cui partire:
Potenziali applicazioni cliniche:
- Screening clinico e selezione dei pazienti da trattare.
- Stabilizzazione della malattia.
- Monitoraggio della risposta al trattamento.
Considerazioni:
- Il potenziale impatto di comorbidità come la malattia renale cronica.
- L’influenza delle differenze razziali sui livelli e sui punti di cutoff dei saggi.
- La necessità di standardizzare i test clinicamente rilevanti.
- Quando eseguire il test.
Valutazione dell’uso prospettico di biomarcatori ematici per la malattia di Alzheimer nell’assistenza primaria e secondaria (ID abstract: 88404)
Presentatore: Oskar Hansson (Svezia)
Biomarcatori plasmatici testati:
- Punteggio di probabilità amiloide (APS)2: rapporto amiloide-β plasmatica 42/40 + rapporto fosforilato (p)-tau217 plasmatico e non-ptau217.
- Rapporto tra p-tau217 e non-ptau217 nel plasma da solo.
Results:
- Il rapporto p-tau217 plasmatico da solo aveva un’accuratezza paragonabile a quella dell’APS2.
- L’accuratezza diagnostica di entrambi i biomarcatori plasmatici si aggira tra l’89% e il 92% in contesti di assistenza primaria e secondaria, in analisi a lotto singolo e prospettiche, quando si utilizzano cutoff a soglia singola e doppia, e per la patologia amiloide del fluido cerebrospinale (CSF) oltre che per l’AD clinica.
- I rispettivi valori predittivi positivi e negativi (PPV e NPVS) variavano dall’86% al 92% e dal 90% al 97%.
- I biomarcatori ematici hanno migliorato significativamente il workup diagnostico standard effettuato dai medici di base e dagli specialisti della demenza.
- Basse percentuali di pazienti “intermedi” basate sulla doppia soglia del 95% di specificità (alto rischio) e del 95% di sensibilità (basso rischio): assistenza primaria 4-13% e assistenza secondaria 6-11%.
Utilità dei biomarcatori plasmatici nello screening dell’amiloide cerebrale nel 1Florida Alzheimer Disease Research Center (ADRC) (ID abstract: 91578)
Presentatore: Ranjan Duara (USA)
- Etnia/razza dei partecipanti: 56% ispanici e 96% bianchi; 3% neri; 1% altri.
- I biomarcatori ematici analizzati sono stati: rapporto amiloide-β 42/40; p-tau217; proteina gliale fibrillare acida (GFAP) e neurofilamento luminoso (NfL).
- Una combinazione di biomarcatori, genotipo APOE e atrofia dell’ippocampo ha predetto la positività della tomografia a emissione di positroni (PET) all’amiloide con “elevata accuratezza”, nei modelli di regressione logistica, utilizzando il cutoff di sensibilità e specificità dell’indice di Youden e tenendo conto di età e sesso.
- Il p-tau217 è risultato il migliore come biomarcatore plasmatico indipendente.
| AUC | Sensitivity | Specificity | |
|---|---|---|---|
| APOE ε4+, hippocampal atrophy+ (base) | 0.78 | 71% | 76% |
| Base plus all plasma biomarkers | 0.96 | 93% | 87% |
| Base plus amyloid-β 42/40 ratio | 0.88 | 80% | 82% |
| Base plus p-tau217 | 0.94 | 92% | 84% |
| p-tau217 | 0.92 | 85% | 89% |
| Amyloid-β 42/40 ratio | 0.82 | 77% | 81% |
| Amyloid-β 42/40 ratio plus p-tau217 | 0.94 | 93% | 85% |
Abbreviazioni: AUC, area sotto la curva caratteristica operativa del ricevitore; APOE, apolipoproteina E.
Uso del p-tau217 plasmatico come metodo di pre-screening per rilevare la positività all’amiloide-PET in partecipanti cognitivamente non compromessi: Uno studio multicentrico (ID abstract: 85773)
Presentatore: Gemma Salvadό (Svezia)
- Cut-off: specificità 90,0%, 95,0%, 97,5%.
- Risultati dopo l’aggiustamento per età e stato APOE:
| p-tau217 only | Subsequent CSF amyloid-β 42/40 in patients positive for p-tau217 | |
|---|---|---|
| Positive predictive value | 72.9–81.2% | 90.8–95.3% ↑ |
| Negative predictive value | 82.5–86.2% | 82.8–86.7% |
| Accuracy | 82.4–83.8% | 84.0–87.3% ↑ |
| Overall rate of amyloid positivity | 10.9–18.1% | 9.3–14.3% ↓ |
| Probability of being assessed as positive on both p-tau217 and CSF | '- | 79.4–85.2% |
- “Il p-tau217 plasmatico potrebbe essere utilizzato, sia come biomarcatore autonomo, sia come fase iniziale prima dei biomarcatori del liquor (riducendone la necessità di circa l’80-90%), per il pre-screening negli studi clinici sull’AD preclinico, a seconda della certezza necessaria per la positività dell’Aβ-PET”, ha affermato Salvadό.
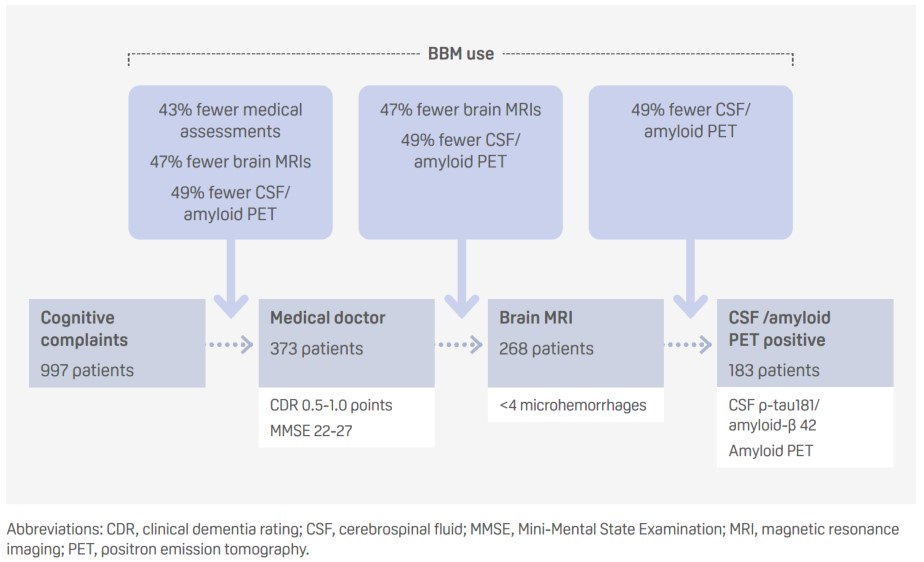
Utilizzo di un pannello di biomarcatori ematici per la malattia di Alzheimer per determinare l’idoneità al trattamento modificante la malattia in una clinica della memoria: tre scenari (Abstract ID: 91700)
Presentatore: Sinthujah Vigneswaran (Paesi Bassi)
- L’uso di biomarcatori ematici (BBM) in diverse fasi della traiettoria diagnostica standard potrebbe aumentare l’efficienza del processo, eliminando la necessità di ulteriori test e riducendo così i costi.
- Il p-tau217 ha rilevato la positività all’amiloide, sulla base di un cutoff dell’indice di Youden del 92% di specificità, con una sensibilità dell’86%, una specificità dell’87% e con tassi di falsi positivi e negativi del 7% e del 32%, rispettivamente.
Valutazione dell’intercambiabilità dei biomarcatori basati sul sangue e dell’amiloide-PET per identificare i pazienti con patologia di Alzheimer (ID abstract: 91465)
Presentatore: Samantha Burnham (USA)
Biomarcatori plasmatici testati:
- PrecivityAD®, che combina i livelli di amiloide-β42/40, APOE ε4 ed età.
- p-tau217.
Stratificazione del plasma:
- Amiloide-β42/40: assenza di placche amiloidi, presenza di placche amiloidi o intermedia.
- p-tau217: negativo, positivo o indeterminato.
Risultati dopo aver escluso il 14,0% dei pazienti intermedi con PrecivityAD® e il 18,6% con p-tau217:
| PrecivityAD® | p-tau217 | |
|---|---|---|
| Ruling in patients also amyloid PET visual read positive (PPV) | 86% | 88% |
| Ruling out patients also amyloid PET visual read negative (NPV) | 78% | 92% ↑ |
| Overall percentage agreement with amyloid PET visual read | 81% | 90% ↑ |
- Entrambi i biomarcatori plasmatici hanno soddisfatto i criteri di non inferiorità rispetto alla PET amiloide a un cutoff di 37 centiloidi (CL) per selezionare i pazienti con patologia amiloide.
- “I risultati supportano l’ipotesi che i biomarcatori del sangue possano essere intercambiabili con i criteri dell’amiloide-PET per selezionare i pazienti che sono adatti e che trarrebbero beneficio dal trattamento con nuove terapie mirate all’amiloide”, ha affermato Burnham.
Test ematici sulla malattia di Alzheimer dei rapporti amiloide-beta 42/40, %p-tau217, 181 e 205 e MTBR-243 in popolazioni reali: Risultati di SEABIRD e BioFINDER2 (ID abstract: 88405)
Presentatore: Randall Bateman (USA)
- La regione plasmatica che lega i microtubuli (MTBR)-tau243 mostra una buona accuratezza diagnostica per la positività della tau-PET e una solida correlazione con la tau PET nelle regioni di Braak tardive, che è coerente tra i pazienti con e senza positività all’amiloide-β.
| All participants n=108 | Amyloid-β-positive participants n=51 | |
|---|---|---|
| MTBR-tau243 | 1.00 | 0.98 |
| p-tau217/tau217 ratio | 0.98 | 0.87 |
| p-tau217 concentration | 0.98 | 0.89 |
| All participants n=108 | Amyloid-β-positive participants n=51 | |
|---|---|---|
| Braak I–VI (Global) | 0.87 | 0.86 |
| Braak I–II | 0.89 | 0.54 |
| Braak III–IV | 0.89 | 0.79 |
| Braak V–VI | 0.85 | 0.86 |
AUC: area sotto la curva caratteristica operativa del ricevitore
- La correlazione con il punteggio del Mini-Mental State Examination (MMSE) è risultata simile per la MTBR-tau243 e per la tau PET in tutti i pazienti (Rho=-0,82 vs -0,69) e in quelli con placche amiloidi (Rho=-0,54 vs -0,53).
Valutazione testa a testa dei principali test ematici per la patologia amiloide (ID abstract: 95506)
Presentatore: Kellen Petersen (USA)
Modelli di regressione logistica che predicono l’accuratezza dei biomarcatori basati sul sangue per prevedere la positività dell’amiloide-PET (>20 CL) utilizzando l’analisi AUC e confrontati con i test di DeLong.
| Platform | Model | AUC |
|---|---|---|
| C2N Precivity™ | p-tau217 ratio* plus amyloid-β 42/40 | 0.929 ★ |
| p-tau217 ratio | 0.927 | |
| p-tau217 plus amyloid-β 42/40 | 0.921 | |
| p-tau217 | 0.916 | |
| amyloid-β 42/40 | 0.751 | |
| Fujirebio Lumipulse® | p-tau217 plus amyloid-β 42/40 | 0.911 |
| ptau217 | 0.896 | |
| amyloid-β 42/40 | 0.787 | |
| AlzPath Simoa® | p-tau217 | 0.885 |
| Janssen Simoa® | p-tau217 | 0.882 |
| Roche Elecsys® | p-tau181 plus amyloid-β 42/40 plus GFAP plus NfL | 0.677 to 0.873 |
| p-tau181 plus amyloid-β 42/40 plus NfL | 0.677 to 0.873 | |
| p-tau181 plus amyloid-β 42/40 | 0.677 to 0.873 | |
| p-tau181 | 0.677 to 0.873 | |
| amyloid-β 42/40 | 0.677 to 0.873 | |
| GFAP | 0.677 to 0.873 | |
| NfL | 0.677 to 0.873 | |
| Quanterix Simoa® | p-tau181 plus amyloid-β 42/40 plus GFAP plus NfL | 0.670 to 0.808 |
| p-tau181 plus amyloid-β 42/40 plus NfL | 0.670 to 0.808 | |
| p-tau181 plus amyloid-β 42/40 | 0.670 to 0.808 | |
| p-tau181 | 0.670 to 0.808 | |
| amyloid-β 42/40 | 0.670 to 0.808 | |
| GFAP | 0.670 to 0.808 | |
| NfL | 0.670 to 0.808 |
AUC: area sotto la curva caratteristica operativa del ricevitore; GFAP: proteina acida fibrillare gliale; NfL: neurofilamento leggero
*p-tau217 rapporto tra p-tau217 e non-ptau217
Un confronto testa a testa tra il p-tau217 plasmatico e la tau-PET per predire il futuro declino cognitivo tra individui cognitivamente non compromessi (ID abstract: 90966)
Presentatore: Rik Ossenkoppele (Paesi Bassi; Svezia)
Il p-tau217 plasmatico predice il declino cognitivo con il mini mental state examination (MMSE) e il modified Preclinical Alzheimer Cognitive Composite (mPACC).
I migliori modelli predittivi:
- MMSE: p-tau217 plasmatico più captazione tau-PET nella neocorteccia temporale (neoT; misurata a meno di un anno di distanza).
- mPACC: assorbimento plasmatico di p-tau217 più tau-PET nel lobo temporale mediale (MTL; misurato a meno di un anno di distanza).
| Cognitive decline on MMSE | Cognitive decline on mPACC | |
|---|---|---|
| Plasma p-tau217 | R2 = 0.14 | R2 = 0.30 |
| MTL tau-PET | R2 = 0.17 | R2 = 0.32 |
| NeoT tau-PET | R2 = 0.21 | R2 = 0.31 |
Biomarcatori di Tau nel plasma per la stadiazione della malattia di Alzheimer (ID abstract: 88408)
Presentatore: Laia Montoliu-Gaya (Svezia)
- Modello di stadiazione della malattia in cinque fasi proposto in base alla positività per quattro peptidi tau plasmatici (p-tau217, p-tau205, 0N CNS-specifico e tau 212-221) in seguito alla quantificazione di sei peptidi tau fosforilati e sei non fosforilati in 553 campioni di plasma di partecipanti alla coorte BioFINDER-2.
- Il modello è stato confrontato con lo stato della PET dell’amiloide (A) e della tau (T) e con gli stadi della PET nel lobo temporale mediale iniziale (MTL) e nella regione neotemporale intermedia (neoT).
| Plasma stage | A/T status | A- T- | A+ T- | A+ T+ | PET stage | MTL+ neoT– | MTL+ neoT+ | MTL+ neoT++ | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Plasma Stage | A/T Status | PET stage | ||||||||||||
| A- T- | A+ T- | A+ T- | MTL+ neoT- | MTL+ neoT+ | MTL+ neoT++ | |||||||||
| Stage 1: negative for all biomarkers | 80.8% | 19.2% | '- | '- | '- | '- | ||||||||
| Stage 2: p-tau217 positive | 3.4% | 40.9% | 55.7% | 22.6% | 22.6% | 31.0% | ||||||||
| Stage 3–4: p-tau217, p-tau205, and 0N CNS-specific positive | '- | '- | 100% | '- | 83.3-86.7% | |||||||||
| Stage 5: p-tau 217, p-tau205, 0N CNS- specific, and tau 212–221 positive | '- | '- | 100% | '- | '- | 100% | ||||||||
- “I nostri dati supportano il concetto di stadiazione dell’AD utilizzando i biomarcatori dei fluidi”, ha affermato Montoliu-Gaya.
Previsione degli stadi patologici di amiloide e tau basati sulla PET con i biomarcatori plasmatici nella malattia di Alzheimer (ID abstract: 90581)
Presentatore: Han-Kyeol Kim (Repubblica di Corea del Sud)
Il rapporto tra p-tau217 plasmatico e non-ptau217 è risultato superiore al p-tau217 e al rapporto tra amiloide-β 42 e amiloide-β 40 per prevedere la fase Thal e lo stadio Braak misurati con la PET, in particolare nelle fasi iniziali.
Le AUC per il rapporto p-tau217/non-p-tau217 nel plasma erano:
- 0,965 per la previsione di Thal fase I-II
- 0,848 per la previsione della fase Thal ≥III
- 0,864 per la previsione di Braak I-II
- 0,925 per la previsione di Braak III-IV
- 0,889 per la previsione di Braak V-VI
Cambiamenti da metà a fine vita nei biomarcatori ematici della patologia e della neurodegenerazione della malattia di Alzheimer e associazioni con il deposito di amiloide nel cervello: Lo studio ARIC-PET (ID abstract: 91307)
Presentatore: Priya Palta (USA)
I biomarcatori plasmatici sono stati misurati a metà vita, a un’età media di 58,5 anni, o in età avanzata, a un’età media di 76,2 anni.
Biomarcatori testati:
- Rapporto tra amiloide-β 42 e amiloide-β 40
- Fosforilato (p)-tau181
- Luce del neurofilamento (NfL)
- Proteina acida fibrillare gliale (GFAP)
Biomarcatori plasmatici a metà vita: Nessuno dei biomarcatori misurati a metà vita ha predetto la positività all’amiloide alla PET in tarda età, definita come un rapporto di valore di captazione standardizzato globale della corteccia superiore a 1,2, una mediana di 19,3 anni dopo.
Biomarcatori plasmatici in età avanzata: Associazioni significative con la positività alla PET per l’amiloide in tarda età quando misurata una media di 1,6 anni prima della morte:
- Rapporto amiloide-β 40/42: odds ratio=2,12
- p-tau181: rapporto di probabilità=1,76
- GFAP: odds ratio=1,72
Terapie anti-amiloide
I punti chiave da cui partire:
- Si raccomanda un dosaggio di durata limitata per donanemab oltre i 12 mesi, che è meglio guidato da una scansione PET visivamente negativa piuttosto che dai livelli di tau.
- Le prove, compresi i dati sui biomarcatori, supportano l’uso precoce di lecanemab e il mantenimento dei benefici fino a 3 anni.
Approfondimenti sul TRAILBLAZER-ALZ 2 (Donanemab): Potenziale traduzione clinica (sessione tematica in via di sviluppo)
Efficienza clinica
Presentatore: Jennifer Zimmer (USA)
- A 76 settimane, donanemab ha ridotto il rischio di progressione della malattia allo stadio successivo della malattia di Alzheimer (AD) in base al Clinical Dementia Rating Global Score (CDR-GS; misurato ogni 3 mesi) di un significativo 37%.
- La percentuale di pazienti che progrediscono verso un’AD moderata (punteggio CDR-GS ≥2 punti) a 76 settimane è stata ridotta di un significativo 50%.
- L’efficacia è risultata coerente tra le varie popolazioni di tau: il rischio di progressione della malattia tra i pazienti con tau medio-bassa e tau alta è stato ridotto rispettivamente del 39% e del 38%.
- Efficacia consistente in tutti i sottogruppi, compresi i partecipanti ispanici/latini.
Rischio ARIA gestibile
Presentatore: Alessandro Biffi (USA)
- Le anomalie di imaging legate all’amiloide – edema/effusioni (ARIA-E) si sono verificate nel 24% dei pazienti che assumevano donanemab – 18% asintomatici e 6% sintomatici.
- Eventi ARIA-E gravi si sono verificati nell’1,5% dei pazienti trattati con donanemab, con conseguente decesso in tre pazienti (0,4%).
- La frequenza più alta di ARIA-E negli omozigoti dell’apolipoproteina (APO)E ε4 (40,6 contro il 15,7% dei non portatori).
- La maggior parte dei pazienti ha avuto un solo episodio di ARIA-E; il 68% dei pazienti è stato ridosato e il 70% non ha avuto recidive.
- Le recidive di ARIA-E tendevano a essere asintomatiche e di entità lieve o moderata.
- I principali fattori di rischio sono:
- Genotipo APOE ε4.
- Numero di microemorragie al basale.
- Presenza di siderosi corticale superficiale al basale.
- Raccomandazioni per la gestione del rischio:
- Identificare i pazienti a rischio più elevato prima del trattamento.
- Rispettare il programma di monitoraggio della risonanza magnetica.
- Titola, interrompi o sospendi il trattamento secondo le necessità.
- Usa i corticosteroidi in caso di ARIA grave o sintomatica.
Dosaggio di durata limitata
Presentatore: Emily Collins (USA)
- I livelli di amiloide sono rimasti bassi tra i pazienti che hanno soddisfatto i criteri di completamento della dose, con un tasso di riaccumulo di 2,8 centiloidi (CL)/anno.
- Il tempo medio per passare al placebo è stato di 47 settimane e la differenza tra i gruppi di trattamento ha continuato ad aumentare oltre questo punto.
- Due terzi dei pazienti avevano livelli di amiloide PET inferiori a 24,1 CL entro 12 mesi e questo era coerente con una scansione PET visivamente negativa, che poteva essere utilizzata per determinare quando interrompere il trattamento.
- Livelli di amiloide più bassi al basale hanno predetto una riduzione più precoce della PET amiloide al di sotto di 24,1 CL.
- La p-tau plasmatica non era sufficientemente accurata per determinare la rimozione dell’amiloide con donanemab perché dopo la rimozione dell’amiloide riflette ancora la patologia della tau.
Esistono prove di un beneficio continuo per il trattamento a lungo termine con Lecanemab? Un aggiornamento sui benefici/rischi dai dati di efficacia, sicurezza e biomarcatori a lungo termine (ID abstract: 92094)
Presentatore: Christopher Van Dyck (USA)
Prove dell’effetto del trattamento continuato con lecanemab fino a 3 anni:
- A 36 mesi, la variazione media del Clinical Dementia Rating-sum of boxes (CDR-SB) rispetto al basale è stata di 3,09 punti, rispetto a una variazione media di 1,20 punti a 18 mesi.
- Questo si è tradotto in una differenza significativa di 0,95 punti nella CDR-SB rispetto ai controlli storici abbinati dello studio ADNI, un aumento della differenza di 0,45 punti rispetto al placebo a 18 mesi e una riduzione del 30% del rischio di progressione allo stadio successivo della malattia.
I gruppi a basso contenuto di tau e amiloide ottengono risultati particolarmente positivi, a sostegno dell’uso precoce di lecanemab:
- Tra i 58 pazienti con PET tau assente o bassa (SUVR <1,06) al basale, il 59% non ha avuto un declino nel punteggio della CDR-SB a 36 mesi e il 51% ha avuto un miglioramento.
- Tra i 151 pazienti con una PET amiloide bassa al basale (<60 CL), il 46% non ha avuto un declino nel punteggio della CDR-SB e il 33% ha avuto un miglioramento.
I dati sui biomarcatori plasmatici supportano l’uso continuato di lecanemab:
- Miglioramento della PET dell’amiloide e del rapporto amiloide-β 42/40 nel plasma entro 3 mesi tra i pazienti che hanno iniziato lecanemab a 18 mesi.
- Il beneficio del trattamento continua da 18 a 36 mesi, nonostante circa il 70% dei pazienti sia negativo all’amiloide (<30 CL) a 18 mesi.
- I livelli plasmatici di p-tau217 diminuiscono nei primi 18 mesi di trattamento con lecanemab ma aumentano con il placebo.
- L’MTBR-tau243 nel liquor è diminuito del 44% dopo 18 mesi di trattamento con lecanemab rispetto al placebo.
Basso rischio ARIA a lungo termine
- Il tasso corretto per l’esposizione di anomalie di imaging legate all’amiloide-edema/effusioni (ARIA-E) è stato di 6,8 per 100 anni-persona con lecanemab nello studio principale e nella fase di estensione, rispetto a 9,6 per 100 anni-persona per il solo studio principale.
- L’ARIA-E si verifica principalmente nei primi 6 mesi di trattamento, dopodiché i casi sono pochi e le percentuali sono simili a quelle del placebo.
- Le ARIA non sono associate a una progressione accelerata a lungo termine.
In che modo i più recenti dati e modelli di farmacologia clinica supportano la continuazione del dosaggio di Lecanemab? (ID abstract: 92091)
Presentatore: Larisa Reyderman (USA)
Studio 201: 31 pazienti con malattia di Alzheimer precoce che hanno interrotto l’assunzione di lecanemab (10 mg/kg ogni 2 settimane) dopo 18 mesi di trattamento, per poi riprenderlo in media 2 anni dopo.
- La duplice azione di lecanemab significa che non solo elimina le placche, ma colpisce anche le protofibrille altamente tossiche che continuano a formarsi e a causare la patologia della malattia di Alzheimer anche dopo la rimozione dell’amiloide.
L’interruzione di lecanemab nello Studio 201 ha portato a:
- 21% di riaccumulo di amiloide PET.
- 47% di peggioramento del rapporto amiloide-β 42/40.
- 30% di riaccumulo di proteina gliale fibrillare acida (GFAP).
- 24% di riaccumulo di p-tau181.
- 13% di riaccumulo di p-tau217.
La modellazione farmacocinetica e farmacodinamica ha dimostrato che metà dell’effetto terapeutico di lecanemab viene perso:
- Dopo 6 mesi per il rapporto amiloide-β 42/40.
- Entro 12,1 anni per la PET amiloide.
- In 1,6 anni per p-tau181.
- In 1,7 anni per GFAP.
La dose mensile di mantenimento di lecanemab 10 mg/kg iniziata a 18 o 24 mesi è sufficiente a prevenire il riaccumulo di amiloide e il peggioramento dei biomarcatori plasmatici.
- Ha avuto un effetto paragonabile al dosaggio bisettimanale per 4 anni in termini di esito clinico misurato dalla PET dell’amiloide e dalla CDR-SB.
Clicca qui sotto per scaricare il pdf di Microdigest 2:
Download Microdigest 2 IT PDFPuoi anche scaricare il Microdigest da AD/PD & CONy:
Download Microdigest 1 IT PDF





