マイクロダイジェスト 2
AAICラウンドアップ
ここでは、新規バイオマーカーと抗アミロイド療法に焦点を当て、AAIC2024で発表された主要データを要約する。
血漿 バイオマーカー
主な収穫
臨床応用の可能性:
- 臨床スクリーニングと治療対象患者の選択。
- 病期分類。
- 治療反応のモニタリング。
検討する:
- 慢性腎臓病などの併存疾患の潜在的影響。
- アッセイを用いたレベルおよびカットオフポイントにおける人種差の影響。
- 臨床的に適切な検査法を標準化する必要性。
- いつテストするか。
プライマリケアとセカンダリケアにおけるアルツハイマー病の血液バイオマーカーの前向き使用の評価(抄録ID:88404)
プレゼンターオスカル・ハンソン(スウェーデン)
血漿バイオマーカーの検査:
- アミロイド確率スコア(APS)2:血漿アミロイドβ42対40比+血漿リン酸化(p)-タウ217対非タウ217比。
- 血漿中のp-tau217と非p-tau217の比率のみ。
Results:
- 血漿p-tau217比のみでもAPS2と同程度の精度があった。
- 両血漿バイオマーカーの診断精度は、プライマリケアとセカンダリケアのセッティング、シングルバッチ解析とプロスペクティブ解析、シングルおよびデュアル閾値カットオフの使用、脳脊髄液(CSF)アミロイド病理と臨床的ADの診断において、89%から92%程度であった。
- それぞれの陽性および陰性的中率(PPVおよびNPVS)は86%から92%、90%から97%であった。
- 血中バイオマーカーは、プライマリケア医や認知症専門医が行う標準治療の診断ワークアップを有意に改善した。
- 特異度95%(高リスク)、感度95%(低リスク)の2つの閾値に基づく「中間」患者の割合が低い:一次医療4~13%、二次医療6~11%。
1Florida Alzheimer Disease Research Center(ADRC)における脳アミロイドのスクリーニングにおける血漿バイオマーカーの有用性(抄録番号:91578)
プレゼンターランジャン・ドゥアラ(米国)
- 参加者の民族/人種:ヒスパニック56%、白人96%、黒人3%、その他1%。
- 血液バイオマーカー:アミロイドβ42/40比、p-tau217、グリア線維性酸性蛋白(GFAP)、ニューロフィラメントライト(NfL)。
- バイオマーカー、APOE遺伝子型、海馬萎縮の組み合わせは、ユーデン指数の感度と特異度のカットオフ値を用い、年齢と性別を考慮したロジスティック回帰モデルにおいて、「高い精度」でアミロイド陽電子放射断層撮影(PET)陽性を予測した。
- p-tau217は、単独の血漿バイオマーカーとして最も優れていた。
| AUC | Sensitivity | Specificity | |
|---|---|---|---|
| APOE ε4+, hippocampal atrophy+ (base) | 0.78 | 71% | 76% |
| Base plus all plasma biomarkers | 0.96 | 93% | 87% |
| Base plus amyloid-β 42/40 ratio | 0.88 | 80% | 82% |
| Base plus p-tau217 | 0.94 | 92% | 84% |
| p-tau217 | 0.92 | 85% | 89% |
| Amyloid-β 42/40 ratio | 0.82 | 77% | 81% |
| Amyloid-β 42/40 ratio plus p-tau217 | 0.94 | 93% | 85% |
略語:AUC:受信者動作特性曲線下面積;APOE:アポリポ蛋白E。
認知障害のない被験者のアミロイドPET陽性検出のための事前スクリーニング法としての血漿p-tau217の使用:多施設共同研究(抄録ID:85773)
プレゼンタージェマ・サルバドό(スウェーデン)
- カットオフ:特異度90.0%、95.0%、97.5%。
- 年齢とAPOEの有無で調整した後の結果:
| p-tau217 only | Subsequent CSF amyloid-β 42/40 in patients positive for p-tau217 | |
|---|---|---|
| Positive predictive value | 72.9–81.2% | 90.8–95.3% ↑ |
| Negative predictive value | 82.5–86.2% | 82.8–86.7% |
| Accuracy | 82.4–83.8% | 84.0–87.3% ↑ |
| Overall rate of amyloid positivity | 10.9–18.1% | 9.3–14.3% ↓ |
| Probability of being assessed as positive on both p-tau217 and CSF | '- | 79.4–85.2% |
- 「血漿p-tau217は、単独バイオマーカーとして、あるいはCSFバイオマーカーの前段階として(バイオマーカーの必要性を80-90%削減する)、Aβ-PET陽性の確実性に応じて、前臨床ADの臨床試験におけるプレスクリーニングに使用することができます」とSalvadό氏は述べた。
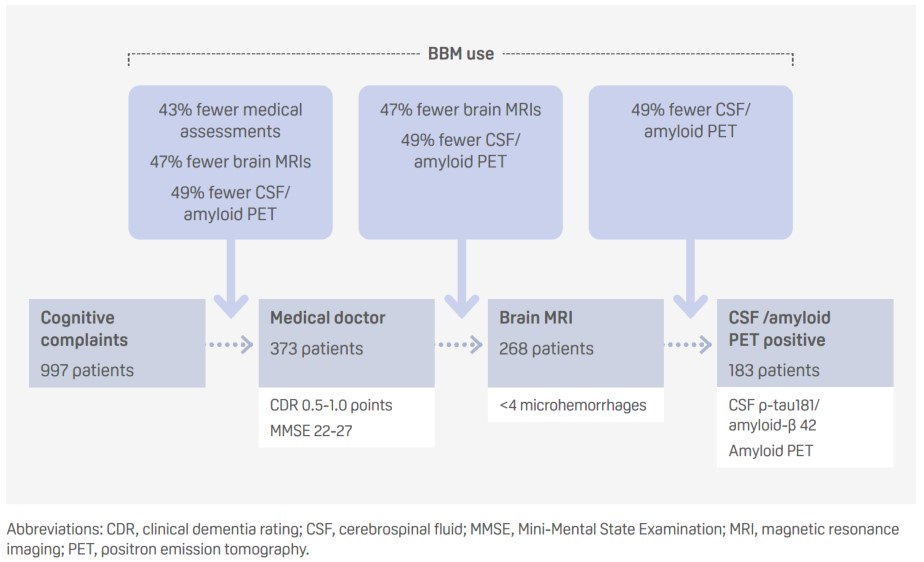
メモリークリニックにおける疾患修飾治療の適格性を決定するためのアルツハイマー病の血液ベースのバイオマーカーパネルの使用:3つのシナリオ(抄録ID:91700)
プレゼンターシンスジャ・ヴィグネスワラン(オランダ)
- 標準的な診断の軌跡の異なる段階において血液ベースのバイオマーカー(BBM)を使用することで、追加検査の必要性を排除するプロセスの効率を高め、それによってコストを削減することができる。
- p-tau217は、特異度92%のYouden’s indexカットオフ値に基づいてアミロイド陽性を検出し、感度は86%、特異度は87%、偽陽性率は7%、偽陰性率は32%であった。
アルツハイマー病患者の同定における血液バイオマーカーとアミロイドPETの互換性の評価(抄録ID:91465)
プレゼンターサマンサ・バーナム(米国)
血漿バイオマーカーの検査:
- アミロイドβ42/40レベル、APOEε4、年齢を組み合わせたPrecivityAD®。
- p-tau217。
血漿の層別化:
- アミロイドβ42/40:アミロイド斑がない、アミロイド斑がある、またはその中間。
- p-tau217:陰性、陽性、不定。
PrecivityAD®では中間患者の14.0%、p-tau217では18.6%を除外した結果:
| PrecivityAD® | p-tau217 | |
|---|---|---|
| Ruling in patients also amyloid PET visual read positive (PPV) | 86% | 88% |
| Ruling out patients also amyloid PET visual read negative (NPV) | 78% | 92% ↑ |
| Overall percentage agreement with amyloid PET visual read | 81% | 90% ↑ |
- 血漿ベースのバイオマーカーはいずれも、アミロイド病変を有する患者を選択するためのカットオフ値37センチロイド(CL)において、アミロイドPETに対する非劣性の基準を満たした。
- 「この結果は、アミロイドを標的とした新規治療法の適応患者を選択するためのアミロイドPET基準と、血液バイオマーカーは交換可能であるという仮説を支持するものです。
実際の集団におけるアミロイドβ42/40、%p-tau217、181、205比、MTBR-243のアルツハイマー病血液検査:SEABIRDとBioFINDER2の結果(抄録ID:88405)
プレゼンターランドール・ベイトマン(米国)
- 血漿微小管結合領域(MTBR)-tau243は、タウPET陽性に対する良好な診断精度と、後期Braak領域におけるタウPETとの強固な相関を示し、これはアミロイドβ陽性の有無にかかわらず一貫している。
| All participants n=108 | Amyloid-β-positive participants n=51 | |
|---|---|---|
| MTBR-tau243 | 1.00 | 0.98 |
| p-tau217/tau217 ratio | 0.98 | 0.87 |
| p-tau217 concentration | 0.98 | 0.89 |
| All participants n=108 | Amyloid-β-positive participants n=51 | |
|---|---|---|
| Braak I–VI (Global) | 0.87 | 0.86 |
| Braak I–II | 0.89 | 0.54 |
| Braak III–IV | 0.89 | 0.79 |
| Braak V–VI | 0.85 | 0.86 |
AUC: 受信者動作特性曲線下面積
- MTBR-tau243とMini-Mental State Examination(MMSE)スコアとの相関は、全患者(Rho=-0.82 vs -0.69)およびアミロイド斑を有する患者(Rho=-0.54 vs -0.53)において、タウPETと同様であった。
アミロイド病態の主要な血液検査法の真っ向からの評価(抄録ID:95506)
プレゼンターケレン・ピーターセン(米国)
アミロイドPET陽性(>20 CL)を予測する血液ベースのバイオマーカーの精度をAUC分析を用いて予測するロジスティック回帰モデルを作成し、DeLongの検定を用いて比較した。
| Platform | Model | AUC |
|---|---|---|
| C2N Precivity™ | p-tau217 ratio* plus amyloid-β 42/40 | 0.929 ★ |
| p-tau217 ratio | 0.927 | |
| p-tau217 plus amyloid-β 42/40 | 0.921 | |
| p-tau217 | 0.916 | |
| amyloid-β 42/40 | 0.751 | |
| Fujirebio Lumipulse® | p-tau217 plus amyloid-β 42/40 | 0.911 |
| ptau217 | 0.896 | |
| amyloid-β 42/40 | 0.787 | |
| AlzPath Simoa® | p-tau217 | 0.885 |
| Janssen Simoa® | p-tau217 | 0.882 |
| Roche Elecsys® | p-tau181 plus amyloid-β 42/40 plus GFAP plus NfL | 0.677 to 0.873 |
| p-tau181 plus amyloid-β 42/40 plus NfL | 0.677 to 0.873 | |
| p-tau181 plus amyloid-β 42/40 | 0.677 to 0.873 | |
| p-tau181 | 0.677 to 0.873 | |
| amyloid-β 42/40 | 0.677 to 0.873 | |
| GFAP | 0.677 to 0.873 | |
| NfL | 0.677 to 0.873 | |
| Quanterix Simoa® | p-tau181 plus amyloid-β 42/40 plus GFAP plus NfL | 0.670 to 0.808 |
| p-tau181 plus amyloid-β 42/40 plus NfL | 0.670 to 0.808 | |
| p-tau181 plus amyloid-β 42/40 | 0.670 to 0.808 | |
| p-tau181 | 0.670 to 0.808 | |
| amyloid-β 42/40 | 0.670 to 0.808 | |
| GFAP | 0.670 to 0.808 | |
| NfL | 0.670 to 0.808 |
AUC: 受信者動作特性曲線下面積; GFAP: グリア線維性酸性タンパク質; NfL: ニューロフィラメントライト
*p-tau217と非p-tau217の比
認知機能が低下していない人の将来の認知機能低下を予測するための血漿p-tau217とタウPETの比較(抄録ID:90966)
プレゼンターリック・オッセンコッペレ(オランダ;スウェーデン)
血漿p-tau217は、mini mental state examination(MMSE)とmodified Preclinical Alzheimer Cognitive Composite(mPACC)における認知機能低下を予測する。
最高の予測モデル:
- MMSE:血漿p-tau217と側頭新皮質におけるタウPET取り込み(neoT;1年以内の間隔で測定)。
- mPACC:内側側頭葉(MTL)における血漿p-tau217とタウPETの取り込み。
| Cognitive decline on MMSE | Cognitive decline on mPACC | |
|---|---|---|
| Plasma p-tau217 | R2 = 0.14 | R2 = 0.30 |
| MTL tau-PET | R2 = 0.17 | R2 = 0.32 |
| NeoT tau-PET | R2 = 0.21 | R2 = 0.31 |
アルツハイマー病病期分類のための血漿中タウバイオマーカー(抄録番号:88408)
プレゼンターライア・モントリウ=ガヤ(スウェーデン)
- BioFINDER-2コホート参加者の血漿553検体において、6種類のリン酸化タウペプチドと6種類の非リン酸化タウペプチドを定量し、4種類の血漿中タウペプチド(p-tau217、p-tau205、0N CNS特異的、tau212-221)の陽性度に基づいて5段階の病期分類モデルを提案。
- このモデルを、アミロイド(A)とタウ(T)のPETの状態、および初期内側側頭葉(MTL)と中間新側頭葉(neoT)領域のPETステージと比較した。
| Plasma stage | A/T status | A- T- | A+ T- | A+ T+ | PET stage | MTL+ neoT– | MTL+ neoT+ | MTL+ neoT++ | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Plasma Stage | A/T Status | PET stage | ||||||||||||
| A- T- | A+ T- | A+ T- | MTL+ neoT- | MTL+ neoT+ | MTL+ neoT++ | |||||||||
| Stage 1: negative for all biomarkers | 80.8% | 19.2% | '- | '- | '- | '- | ||||||||
| Stage 2: p-tau217 positive | 3.4% | 40.9% | 55.7% | 22.6% | 22.6% | 31.0% | ||||||||
| Stage 3–4: p-tau217, p-tau205, and 0N CNS-specific positive | '- | '- | 100% | '- | 83.3-86.7% | |||||||||
| Stage 5: p-tau 217, p-tau205, 0N CNS- specific, and tau 212–221 positive | '- | '- | 100% | '- | '- | 100% | ||||||||
- 「我々のデータは、体液バイオマーカーを用いてADを病期分類するという考え方を支持しています」とMontoliu-Gaya氏は語った。
アルツハイマー病における血漿バイオマーカーを用いたPETによるアミロイド・タウ病態の予測(抄録ID:90581)
プレゼンターキム・ハンギョル(韓国)
血漿中のp-tau217と非p-tau217の比は、PETを用いて測定したThal期とBraak期の予測において、特に初期において、p-tau217とアミロイドβ42とアミロイドβ40の比よりも優れていた。
血漿中p-tau217/非p-tau217比のAUCは以下の通りであった:
- タール第I-II相の予測に0.965
- 0.848(タール相≥IIIを予測する場合
- 0.864(ブレイクI-IIを予測する場合
- 0.925(ブレイクIII~IVを予測する場合
- 0.889 ブレイクV-VIを予測する場合
アルツハイマー病の病態と神経変性の血液バイオマーカーにおける中年期から晩年期の変化と脳アミロイド沈着との関連:ARIC-PET研究(抄録ID:91307)
プレゼンタープリヤ・パルタ(米国)
血漿バイオマーカーは、平均年齢58.5歳の中年期、または平均年齢76.2歳の後年期に測定された。
検査されたバイオマーカー:
- アミロイドβ42とアミロイドβ40の比率
- リン酸化(p)-tau181
- 神経フィラメント光(NfL)
- グリア線維酸性タンパク質(GFAP)
中年期の血漿バイオマーカー中年期に測定されたバイオマーカーはいずれも、19.3年後の中央値で1.2以上の大脳皮質標準化取り込み値比として定義される後期PETアミロイド陽性を予測しなかった。
後期血漿バイオマーカー:PETによる後期アミロイド陽性との有意な関連:PETによる後期アミロイド陽性となる1.6年前(中央値)に測定した場合:
- アミロイドβ40/42比:オッズ比=2.12
- p-tau181:オッズ比=1.76
- GFAP:オッズ比=1.72
抗アミロイド療法
主な収穫
- ドナネマブの12ヵ月以上の投与は、タウ値よりもPETスキャンが陰性であることを確認することが重要である。
- バイオマーカーデータを含むエビデンスは、レカネマブの早期使用と3年までの継続的有用性を支持している。
TRAILBLAZER-ALZ 2(ドナネマブ)からの洞察:臨床転化の可能性(発展トピックセッション)
臨床効率性
プレゼンタージェニファー・ジマー(米国)
- 76週時点で、ドナネマブはClinical Dementia Rating Global Score(CDR-GS;3ヵ月ごとに測定)において、アルツハイマー病(AD)の次の病期への進行リスクを37%有意に減少させた。
- 76週目に中等度AD(CDR-GSスコア2点以上)に進行した患者の割合は、50%有意に減少した。
- 有効性はタウ集団間で一貫しており、低中等度タウ患者では39%、高タウ患者では38%の有意な病勢進行リスクの減少がみられた。
- ヒスパニック系/ラテン系の参加者を含むサブグループ間で一貫した有効性。
管理可能なARIAリスク
プレゼンターアレッサンドロ・ビッフィ(米国)
- アミロイド関連画像異常-浮腫/滲出(ARIA-E)はドナネマブ投与患者の24%に発現し、18%が無症状、6%が症候性であった。
- 重篤なARIA-E事象はドナネマブ投与患者の1.5%に発現し、3例(0.4%)が死亡した。
- アポリポ蛋白(APO)Eε4ホモ接合体のARIA-E頻度が最も高い(非保有者の15.7%に対して40.6%)。
- ほとんどの患者はARIA-Eのエピソードを1回経験しただけであり、68%の患者は再投与を受け、70%の患者で再発はみられなかった。
- ARIA-Eの再発は無症状で軽度から中等度の傾向があった。
- 主な危険因子は以下の通り:
- APOEε4遺伝子型。
- ベースラインの微小出血の数。
- ベースライン時の皮質表層部シデローシスの有無。
- リスク管理に関する提言
- 治療前にリスクの高い患者を特定する。
- MRIモニタリングスケジュールを遵守する。
- 必要に応じて、治療を漸増、中断、中止する。
- 重症または症候性のARIAには副腎皮質ステロイドを使用する。
投与期間の制限
プレゼンターエミリー・コリンズ(米国)
- 投与完了基準を満たした患者のアミロイド濃度は低いままであり、再蓄積率は2.8セントロイド(CL)/年であった。
- プラセボに切り替わるまでの平均期間は47週で、この時点以降も治療群間の差は拡大し続けた。
- 患者の3分の2は、12ヵ月後までにアミロイドPETレベルが24.1CL未満であり、これはPETスキャンが視覚的に陰性であったことと一致しており、治療中止時期の判断に役立てることができた。
- ベースラインのアミロイドレベルが低いほど、アミロイドPETが24.1CL未満まで早期に減少することが予測された。
- 血漿p-tauはドナネマブによるアミロイド除去の判定には十分な精度ではなかった。アミロイド除去後もタウ病態を反映するからである。
レカネマブの長期投与が引き続き有益であることを示すエビデンスはあるか?有効性、安全性、およびバイオマーカーの長期データから得られたベネフィット/リスクの最新情報(抄録番号:92094)
プレゼンタークリストファー・ヴァン・ダイク(米国)
lecanemabによる治療効果が3年間継続することを示すエビデンス:
- 36ヵ月後の臨床的認知症評価(CDR-SB)のベースラインからの平均変化点は3.09点であったのに対し、18ヵ月後の平均変化点は1.20点であった。
- これは、ADNI試験でマッチさせた過去の対照群と比較したCDR-SBの有意差0.95ポイント、18ヵ月時点のプラセボとの差0.45ポイントを上回り、次の病期への進行リスクを30%減少させた。
低タウ群とアミロイド群は特に良好で、レカネマブの早期使用を支持している:
- ベースライン時にタウPETがない、あるいは低い(SUVR<1.06)患者58人のうち、59%は36ヵ月時点でCDR-SBスコアの低下がなく、51%は改善していた。
- ベースライン時(<60CL)にアミロイドPETが低かった151人の患者のうち、46%はCDR-SBスコアの低下がみられず、33%は改善した。
血漿バイオマーカーのデータはレカネマブの継続使用を支持するものである:
- レカネマブ開始18ヵ月目の患者において、アミロイドPETと血漿アミロイドβ42/40比が3ヵ月以内に改善した。
- 患者の約70%が18ヵ月時点でアミロイド陰性(CL30未満)であったにもかかわらず、18ヵ月から36ヵ月まで治療効果が持続した。
- p-tau217の血漿中濃度はレカネマブ治療により最初の18ヵ月で低下するが、プラセボでは上昇する。
- CSFのMTBR-tau243は、レカネマブによる18ヵ月間の治療後、プラセボと比較して44%低下した。
低い長期ARIAリスク
- アミロイド関連画像異常-浮腫/滲出症(ARIA-E)の曝露調整率は、コア試験と延長相を通じて、レカネマブ投与群では100人年当たり6.8人であったのに対し、コア試験単独群では100人年当たり9.6人であった。
- ARIA-Eは主に治療開始後6ヵ月に発現するが、その後はほとんど発現せず、プラセボと同程度の発現率である。
- ARIAは長期進行の促進とは関連しない。
最新の臨床薬理学データとモデリングはレカネマブの継続投与をどのようにサポートするか?(抄録ID:92091)
プレゼンターラリサ・レイダーマン(米国)
201試験: 初期アルツハイマー病患者31例で、lecanemab(10mg/kg、2週毎)の投与を18ヵ月後に中止し、平均2年後に再開した。
- レカネマブの二重作用は、プラークを除去するだけでなく、アミロイドが除去された後も形成され続け、アルツハイマー病の病態を引き起こす毒性の強い原線維も標的にすることを意味する。
201試験でレカネマブが中断された:
- アミロイドPETの再蓄積21%。
- アミロイドβ42/40比が47%悪化。
- グリア線維酸性タンパク質(GFAP)の30%の再蓄積。
- p-tau181の再蓄積は24%。
- 13%のp-tau217の再蓄積。
薬物動態学的および薬力学的モデリングにより、レカネマブの治療効果の半分が失われることが示された:
- アミロイドβ42/40比については6ヵ月後。
- アミロイドPETでは12.1年以内。
- p-tau181は1.6年後。
- GFAPは1.7年後。
アミロイドの再蓄積と血漿バイオマーカーの悪化を防ぐには、18ヵ月後または24ヵ月後に開始するレカネマブ10mg/kgの月1回の維持投与で十分である。
- アミロイドPETとCDR-SBによる臨床転帰の測定では、隔週投与と同等の効果が4年間持続した。
マイクロダイジェスト2のPDFをダウンロードするには、以下をクリックしてください:
マイクロダイジェスト2 JP PDFをダウンロードまた、AD/PD & CONyからマイクロダイジェストをダウンロードすることもできる:
マイクロダイジェスト1 JP PDFをダウンロード





