Microdigesto 3
Resumen del CTAD
Aquí resumimos los principales datos publicados en CTAD 2024, centrados en nuevos biomarcadores y terapias antiamiloides.

Selección para ensayos clínicos
Puntos clave:
- El cociente p-tau217 es un biomarcador apropiado para reducir la tasa de fracaso del cribado mediante tomografía por emisión de positrones (TEP) de amiloide-β en todos los grupos raciales y étnicos.
- Las tasas más bajas de elegibilidad plasmática sugieren una prevalencia diferencial de la anomalía amiloide en los grupos raciales y étnicos infrarrepresentados, lo que contribuye a su infrarrepresentación en los ensayos de tratamiento antiamiloide.
- La TEP de Tau es un buen criterio de valoración del ensayo que se correlaciona estrechamente con la cognición.
El estudio AHEAD 3-45: diseño y resultados de un novedoso proceso de selección para un ensayo preclínico de EA (Resumen: LBS1)
El estudio AHEAD 3-45 consta de dos ensayos hermanos:
- A3 es un ensayo de fase 2, de 4 años de duración, de lecanemab intravenoso (titulación de 5 mg/kg seguida de 10 mg/kg mensuales durante 208 semanas) frente a placebo en individuos sin deterioro cognitivo que tienen un PET de amiloide-β intermedio (20-40 centiloides [CL]). El objetivo es prevenir el deterioro cognitivo (Preclinical Alzheimer’s Cognitive Composite 5 [PACC-5]) durante un periodo de 4 años.
- El A45 es un ensayo de fase 3, de 4 años de duración, de lecanemab intravenoso (5 mg/kg quincenales durante 6 semanas, seguidos de 10 mg/kg quincenales durante 86 semanas y luego mensuales durante 120 semanas) frente a placebo en individuos sin deterioro cognitivo que dan positivo en la PET de amiloide-β (≥40 CL). El objetivo es frenar la acumulación de amiloide-β (PET amiloide y PET tau).
Acaba de finalizar el periodo de selección.
Cribado de biomarcadores plasmáticos, imágenes PET de amiloide y tau en el estudio AHEAD 3-45 (Presentación 2)
Presentador: Reisa Sperling (EE.UU.)
- Proceso de selección tanto para A3 como para A45:
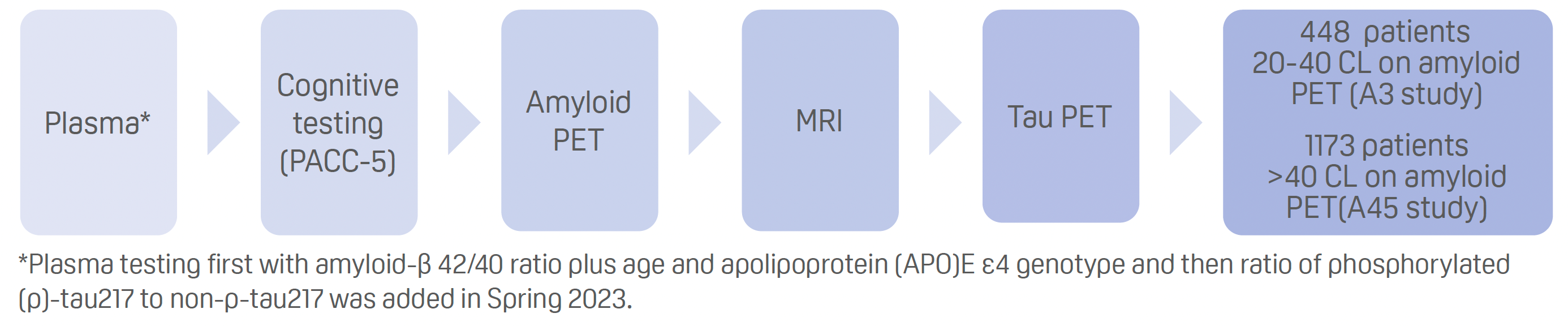
Resultados:
- La inclusión de pruebas plasmáticas de la relación amiloide-β42/40 redujo la tasa de fracaso de la PET amiloide para predecir más de 11 CL de alrededor del 75% a aproximadamente el 55%.
- La adición del cociente p-tau217 redujo aún más la tasa de fracaso de la PET amiloide para predecir más de 18 CL a aproximadamente un 40-45%.
- El cociente p-tau217 plasmático alcanzó un área bajo la curva característica operativa del receptor de 0,95 para la PET amiloide en 20 CL de elegibilidad.
- Las pruebas plasmáticas con el modelo completo de pruebas plasmáticas redujeron la tasa de fracaso de la PET amiloide para predecir más de 40 CL al 25%.
- La PET de tau neocortical y del lóbulo temporal medial era mayor en los participantes del estudio A45 que en los del A3.
- La Tau PET mostró la correlación más fuerte con la cognición en el PACC-5.
“El aumento precoz del cociente p-tau217 puede resultar útil para realizar ensayos de intervención aún más tempranos dirigidos a prevenir la futura positividad amiloide”, afirma Sperling. “Los hallazgos apoyan la PET de tau como criterio de valoración clave, sirviendo como posible resultado puente entre la imagen, los biomarcadores y la cognición a través de A3 y A45”.
Diferencias raciales y étnicas en las tasas de elegibilidad del biomarcador plasmático p-tau217 en un ensayo preclínico de EA (Presentación 3)
Presentadora: Doris Molina Henry
- Comprender la capacidad del algoritmo de biomarcadores plasmáticos, durante la ventana en la que se añadió el cociente p-tau 217, para detectar la elegibilidad del PET amiloide a más de 18 CL en diferentes grupos raciales y étnicos infrarrepresentados.
Resultados:
- Tasas de elegibilidad por plasma más bajas en todos los grupos raciales y étnicos infrarrepresentados, en comparación con los adultos blancos no hispanos.
- Las tasas de elegibilidad para la PET entre los participantes aptos para plasma fueron comparables para los distintos grupos raciales/étnicos, sin diferencias significativas.
| Grupo racial/étnico | Número | Tasa de elegibilidad de plasma | Porcentaje de pacientes elegibles para plasma que también eran elegibles para PET |
|---|---|---|---|
| Asiáticos no hispanos | 155 | 15% | 50% |
| Hispano Blanco | 877 | 19% | 63% |
| Negro no hispano | 511 | 19% | 68% |
| Blanco no hispano | 4832 | 27% | 71% |
| Hispano Negro | 62 | 11% | 75% |
“Las tasas más bajas de elegibilidad plasmática sugieren una prevalencia diferencial de la anomalía amiloide en estos grupos […] lo que sugiere que hay niveles más bajos de amiloide en individuos de grupos racial y étnicamente infrarrepresentados, lo que contribuye a su infrarrepresentación en los ensayos antiamiloides”, afirma Henry.
“La elegibilidad para la PET fue la misma en todos los grupos, lo que apoya que se aplicaron adecuadamente los mismos algoritmos de predicción del plasma en todos los grupos raciales y étnicos”, añadió.
“Esto sugiere […] que otros factores pueden explicar el mayor riesgo de demencia en individuos de grupos raciales y étnicos infrarrepresentados que tienen menor prevalencia de amiloide”.
Biomarcadores y diagnóstico de la EA
Puntos clave:
- La β-sinucleína puede representar un nuevo biomarcador sináptico de base sanguínea en la enfermedad de Alzheimer (EA).
- El tiempo transcurrido en cada 0,5 unidades de la Escala de Calificación de la Demencia Clínica-Suma de Casillas podría ayudar a evaluar la respuesta al tratamiento.
- Una prueba de biomarcadores sanguíneos multianalitos puede ayudar en la toma de decisiones diagnósticas.
- Es necesario abordar las disparidades raciales/étnicas en la positividad de la tomografía por emisión de positrones (PET) amiloide y el estadio clínico en el momento del diagnóstico para mejorar el acceso al tratamiento.
- Es necesario desarrollar estrategias para facilitar la interpretación del rendimiento de la p-tau217 en el contexto de afecciones médicas comórbidas como la enfermedad renal crónica.
- Las distintas funciones de los biomarcadores sanguíneos podrían allanar el camino para un enfoque diagnóstico escalonado de la EA.
- Se recomiendan más pruebas cuando las medidas del líquido cefalorraquídeo (LCR) y la PET difieren en la positividad del amiloide-β antes de recomendar un tratamiento antiamiloide.
Aumento precoz del marcador sanguíneo sináptico β-sinucleína en individuos asintomáticos con enfermedad de Alzheimer autosómica dominante enfermedad de Alzheimer autosómica dominante (ID resumen OC14)
Presentador: Patrick Oeckl (Alemania)
- Se utilizó la espectrometría de masas por inmunoprecipitación para cuantificar la proteína presináptica β-sinucleína en muestras de sangre de 178 participantes en el estudio Red de Alzheimer de Herencia Dominante (DIAN).
- Se incluyeron 31 portadores sintomáticos de mutaciones, 78 portadores asintomáticos de mutaciones y 69 no portadores de mutaciones sin deterioro cognitivo.
Resultados:
- Los niveles de β-sinucleína eran significativamente más altos en los pacientes asintomáticos con EA autosómica dominante que en los individuos sin deterioro cognitivo, y más altos en los pacientes sintomáticos.
- Los niveles de β-sinucleína en sangre empezaron a aumentar en los portadores de la mutación aproximadamente 11 años antes de la aparición de los síntomas.
- Clasificación según el momento en que los niveles de biomarcadores de fluidos divergen significativamente entre portadores y no portadores de mutaciones, de más temprano a más tardío:
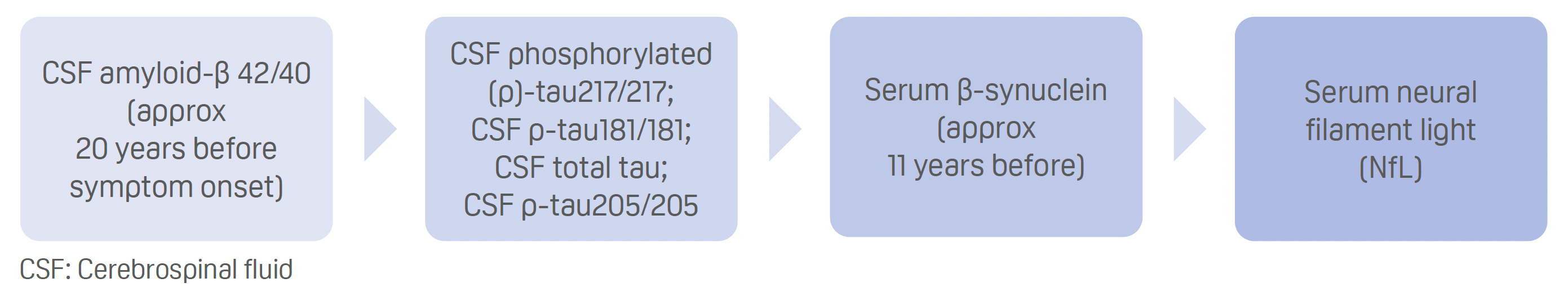
- La trayectoria de la β-sinucleína sérica precede a las medidas de imagen del deterioro cognitivo, la atrofia cerebral y el hipometabolismo.
- La β-sinucleína sérica tenía una capacidad moderada para predecir la positividad del amiloide-β (área bajo la curva característica operativa del receptor de 0,75).
- La β-sinucleína sérica se correlacionó significativamente con el deterioro cognitivo.
La β-sinucleína sanguínea podría ser un “marcador sináptico de fácil acceso para el diagnóstico, el pronóstico y el desarrollo de fármacos [and] “, afirma Oeckl.
Progresión clínica en el CDR-SB: tiempo de permanencia en cada nivel en las cohortes DIAN y ADNI (Resumen OC19)
Presentador: Guoqiao Wang (EEUU)
- Se examinó el tiempo que pasan las personas en cada nivel de 0,5 unidades de la Escala de Calificación de la Demencia Clínica-Suma de Casillas (CDR- SB) antes de progresar al siguiente nivel, denominado tiempo de permanencia, en dos cohortes: DIAN (EA autosómica dominante) y ADNI (EA esporádica), utilizando un modelo de efectos aleatorios para la progresión de la enfermedad.
Resultados:
- EA autosómica dominante: Tiempo de residencia por CDR-SB de 0,5 unidades de 0,5 años o menos cuando el CDR-SB alcanza 3 puntos o más.
- EA esporádico: Tiempo de residencia por CDR-SB de 0,5 unidades de 0,5 años o menos cuando el CDR-SB alcanza 3,5 puntos o más.
- Tiempo de permanencia para pasar de una puntuación CDR-SB de 0,5 a 3,5 puntos: media de 6,5 años para la EA autosómica dominante y de 5,6 años para la EA esporádica, una diferencia de aproximadamente 0,9 años.
Utilizando el tiempo de permanencia, podría calcularse un efecto del tratamiento para los pacientes de la fase de extensión abierta del ensayo Clarity AD de lecanemab, por ejemplo:
- A partir de una puntuación CDR-SB basal de 3,17 puntos, se estimó que los pacientes tratados con placebo tardarían 2,3 años en disminuir 3,09 puntos y los tratados con lecanemab tardarían 3,0 años, un retraso en la progresión de la enfermedad de 0,7 años.
El tiempo de residencia en cada nivel de 0,5 unidades en CDR-SB “podría proporcionar una forma estandarizada y alternativa de interpretar y evaluar el efecto del tratamiento“, dijo Wang.
Discrepancias entre las determinaciones por LCR y PET del amiloide cerebral elevado y su importancia pronóstica (Resumen: LB10)
Presentador: David Knopman (EEUU)
- Se evaluó el deterioro cognitivo tras medidas discordantes de LCR y PET de la positividad del amiloide-β en 587 participantes de la cohorte ADNI que presentaban deterioro cognitivo leve.
Resultados:
- Los resultados discordantes de las pruebas fueron poco frecuentes, con una tasa aproximada del 5%.
- Los pacientes que obtuvieron resultados negativos tanto en el LCR como en la PET para amiloide y los que obtuvieron resultados discordantes (obtuvieron resultados negativos en cualquiera de las dos pruebas) tenían una cognición similar al inicio del estudio, y la cognición era mejor en comparación con los que obtuvieron resultados positivos en ambas medidas.
- En los pacientes que dieron positivo en amiloide en LCR, pero no en amiloide en PET, los cocientes p-tau/amiloide-β en LCR fueron sustancialmente inferiores a los de los pacientes que dieron positivo en ambas medidas.
- Durante una mediana de 4 años de seguimiento, los pacientes con resultados discordantes en las pruebas no presentaron un descenso significativo en las puntuaciones de la Prueba de Aprendizaje Verbal Auditivo Rey Suma de Ensayos 1-6 ni de la Escala de Calificación de la Demencia Clínica-Suma de Casillas, a diferencia de los pacientes con resultados positivos en ambas medidas.
- Las tasas de demencia incidente durante el seguimiento sólo fueron significativamente elevadas en los pacientes que dieron positivo en ambas medidas (17,3 por 100 personas-año), mientras que los pacientes con resultados negativos o discordantes en ambas medidas tuvieron tasas similares (entre 1,9 y 3,0 por 100 personas-año).
“Dado que las personas con DCL con patrón LCR positivo/PET negativo no mostraron un declive por grupos, deberían obtenerse pruebas adicionales de la probabilidad de progresión de la enfermedad antes de recomendarles el tratamiento con anticuerpos monoclonales antiamiloides”, afirmó Knopman.
Evaluación del impacto de una prueba de biomarcadores sanguíneos multianalitos para evaluar el deterioro cognitivo: resultados del estudio de utilidad clínica QUIP II (Resumen OC32)
Presentador: Joel Braunstein (EEUU)
- Se encuestó a 12 clínicos que trataban a 203 pacientes con deterioro cognitivo para evaluar el uso de PrecivityAD2 (C2N Diagnostics, San Luis, Misuri, EE.UU.) en la gestión clínica y la toma de decisiones.
- El análisis de sangre cuantifica los niveles plasmáticos de amiloide-β42 y 40, así como de p-tau217 y no p-tau217, para dar una puntuación de probabilidad de amiloide (APS)2, de 0 a 100 puntos, donde una puntuación de 0-47 significa un resultado negativo y una baja probabilidad de positividad amiloide y una puntuación de 48-100 puntos un resultado positivo y una alta probabilidad.
Resultados:
- El 51% de los pacientes dieron negativo.
- Concordancia del 99% con el uso previsto.
- 75% de cambio en la certeza diagnóstica de la EA, el tratamiento farmacológico o nuevas evaluaciones del amiloide cerebral.
- Débil correlación entre el resultado del APS2 y la probabilidad de EA informada por el clínico antes de utilizar el análisis de sangre, y una fuerte correlación después.
- Para los pacientes negativos, la probabilidad de EA comunicada por el clínico disminuyó del 53% antes de utilizar el análisis de sangre al 11%, y para los pacientes positivos, aumentó del 65% al 93%.
- Hubo una disminución significativa de la prescripción de fármacos antidepresivos entre los pacientes negativos antes y después de utilizar el análisis de sangre, y un aumento significativo entre los pacientes positivos.
- Las pruebas adicionales de amiloide cerebral disminuyeron un 70% en los pacientes negativos y un 26% en los positivos.
“Creemos que […] el análisis de sangre PrecivityAD2™ condujo a cambios clínicamente significativos en la toma de decisiones en torno a la certeza diagnóstica de la EA, la gestión del tratamiento farmacológico y la evaluación adicional del amiloide entre los pacientes evaluados por deterioro cognitivo”, afirmó Braunstein.
Presentador: Gil Rabinovici (EEUU)
Diferencias en los resultados de la PET amiloide y los determinantes sociales de la salud según raza/etnia: resultados de New IDEAS (Resumen OC08)
- Se compararon las tasas de positividad de la PET amiloide, el estadio clínico y los determinantes sociales de la salud en 4.845 participantes de New IDEAS con deterioro cognitivo leve (DCL; 64%) o demencia (37%), de los cuales el 21% se autoidentificaron como negros/afroamericanos (BAA), el 18% como latinos/hispanos (LAT) y el 61% como de otra raza o etnia (NBL).
Resultados
Los grupos BAA y LA fueron:
- una probabilidad significativamente un 28% menor que el grupo NBL de dar positivo en la PET-amiloide, con tasas respectivas del 60,7% y el 60,8% frente al 68,2%;
- más probabilidades de tener comorbilidades vasculares, como hipertensión (73,3 y 61,5 frente a 54,3%) y diabetes (29,9% y 29,8% frente a 16,3%);
- más probabilidades de presentar demencia, en relación con el DCL, que el grupo NBL, con una tasa del 47,4% y del 43,5% frente al 30,5%;
- Es más probable que tengan una presentación atípica y, por tanto, más difícil de diagnosticar (36,0% y 35,55 frente a 26,6%);
- más propensos a tener puntuaciones medias del mini examen del estado mental más bajas de media al inicio del estudio que el grupo NBL (21 y 21 frente a 25 puntos).
“Abordar estas disparidades modificables es fundamental para mejorar la equidad en el acceso a la asistencia y la aplicación de estrategias de prevención de la demencia”, afirma Rabinovici.
Rendimiento de la p-tau217 plasmática en una cohorte afroamericana: resultados del estudio African Americans fighting Alzheimer’s in midlife (Resumen: OC13)
Presentadora: Gilda Ennis (EEUU)
- Se evaluó la precisión de la p-tau217 plasmática para detectar la positividad de la PET amiloide en 233 adultos sin deterioro cognitivo identificados como negros o afroamericanos no hispanos de la cohorte AA-FAIM que tenían al menos una de las siguientes afecciones comórbidas: deterioro de la función renal, enfermedad cardiovascular, hipertensión, diabetes u obesidad.
Resultados
- Los niveles plasmáticos más altos de p-tau217 se asociaron significativamente con el deterioro leve de la función renal (tasa de filtración glomerular estimada [eGFR] inferior a 90 ml/min por 1,73m2) y de moderado a grave (TFGe inferior a 60 ml/min por 1,73m2), así como con la enfermedad cardiovascular (infarto de miocardio, ictus o insuficiencia cardiaca congestiva).
- Ninguna de las dos asociaciones pudo explicarse por la carga amiloide en pequeñas submuestras de 38 y 64 individuos, respectivamente.
- Los niveles plasmáticos de p-tau217 no aumentaron significativamente en los pacientes que tenían hipertensión en estadio 1 o 2, diabetes u obesidad, tras controlar la edad y el sexo.
- La precisión de la p-tau217 plasmática para detectar la positividad de la PET amiloide en 65 pacientes de la cohorte AA-FAIM fue del 90% en un punto de corte de 0,35 pg/mL, con una sensibilidad del 94% y una especificidad del 80% (la iniciativa Global CEO sobre EA recomienda un 90% y un 85%, respectivamente, para el uso en atención primaria de biomarcadores sanguíneos).
“Necesitamos investigar estrategias que faciliten la interpretación precisa de la p-tau 217 plasmática en el contexto de afecciones médicas que aumentan o disminuyen falsamente la p-tau217″, afirma Ennis.
Funciones diferenciales de los biomarcadores plasmáticos de la enfermedad de Alzheimer en el diagnóstico guiado por biomarcadores por pasos: comparación directa entre una población asiática (Resumen: OC38)
Presentador: Daeun Shin (República de Corea)
- Se estudiaron las funciones diferenciales de los marcadores plasmáticos en 2984 personas asiáticas (22% sin deterioro cognitivo, 68% con deterioro cognitivo por EA, 6% con deterioro cognitivo vascular subcortical, 3% con demencia frontotemporal) para ver si podían utilizarse como parte de una estrategia escalonada para un diagnóstico más eficaz de la EA guiado por biomarcadores.
- Biomarcadores plasmáticos estudiados: amiloide-β 42/40; p-tau181; p-tau217; p-tau231; GFAP; NfL.
Resultados
| Mejor biomarcador | Papel | AUC |
|---|---|---|
| NfL | Distinguía a los pacientes con cualquier deterioro cognitivo de los individuos sin deterioro | 0,71-0,94 |
| p-tau217 | Discriminó la positividad de la PET de amiloide-β en todos los grupos | 0,88–0,95 |
| p-tau217 | Discriminó la positividad de tau PET en pacientes con deterioro cognitivo AD | 0,90–0,91 |
| p-tau217 | Distinguió a los pacientes con PET-β-amiloide positivos con deterioro cognitivo de EA de los pacientes con PET-β-amiloide negativos con demencias no EA. | 0,94–0,95 |
| p-tau217 y luego GFAP | Predijo el deterioro cognitivo en pacientes sin deterioro cognitivo | N/A |
AUC: área bajo la curva receiver operating characteristic; N/A: no aplicable; NfL: luz de neurofilamento; p: fosforilado; PET: tomografía por emisión de positrones; GFAP: proteína ácida fibrilar glial
“Estos hallazgos subrayan la importancia de las funciones diferenciales de los biomarcadores plasmáticos de la enfermedad de Alzheimer en un enfoque de diagnóstico escalonado”. afirma Shin.
Terapias antiamiloides
Puntos clave:
- Se han emitido recomendaciones de uso apropiado del donanemab para ayudar a identificar a los candidatos adecuados para el tratamiento.
- La elegibilidad para la terapia antiamiloide es relativamente baja y podría mejorarse con un cribado más amplio que incluyera biomarcadores sanguíneos.
- Los pacientes del mundo real están siendo seleccionados adecuadamente y reciben lecanemab de acuerdo con la información de etiquetado aprobada por la FDA.
- El lecanemab es bien tolerado por los pacientes en la clínica y las tasas de adherencia son buenas.
Donanemab: recomendaciones de uso apropiado (Resumen: LB01)
Presentador: Gil Rabinovici (EEUU)
- Las recomendaciones fueron elaboradas por el Grupo de Trabajo Terapéutico sobre EA y Trastornos Relacionados basándose en los datos de los ensayos clínicos con donanemab, la información de prescripción de la FDA y otra bibliografía relevante, junto con la opinión de expertos.
Resultados
Los pacientes elegibles para el tratamiento con donanemab deben tener:
- Deterioro cognitivo leve (DCL) o demencia leve debida a EA: Estadios clínicos 3-4 en la Escala de Deterioro Global y una puntuación en el Mini-Examen del Estado Mental (MMSE) de 20-30 puntos.
- Evidencia de patología amiloide-β confirmada mediante biomarcadores del líquido cefalorraquídeo (LCR) (amiloide-β 42/40 o cocientes fosforilados (p)-tau 181/amiloide-β 42) o tomografía por emisión de positrones (PET).
- Genotipado de la apolipoproteína (apo)E y resonancia magnética (RM) realizados antes del tratamiento.
No son elegibles para el tratamiento con donanemab:
- Pacientes con evidencia en la RM de enfermedad grave de la sustancia blanca o angiopatía amiloide cerebral significativa, como más de cuatro microsangrados, una macrohemorragia de más de 1 cm o siderosis superficial.
- Pacientes que toman anticoagulantes.
Otras recomendaciones:
- No deben utilizarse trombolíticos durante el tratamiento con donanemab; la trombectomía mecánica es factible.
- Interrupción de donanemab si la RM muestra alguna macrohemorragia, más de un área de siderosis superficial, más de 10 microhemorragias, más de dos episodios de anomalías de imagen relacionadas con el amiloide (ARIA) o ARIA grave.
- Considera la interrupción del tratamiento a los 12-18 meses si el PET amiloide de seguimiento es negativo.
Rabinovici dijo que se trata de “recomendaciones, no son directrices ni criterios, y como siempre que se trata a un paciente individual, el juicio clínico es primordial”.
Elegibilidad para el tratamiento antiamiloide en poblaciones clínicas de memoria del mundo real (Resumen: OC22)
Presentadora: Anna Matton (Suecia)
- Las recomendaciones de uso adecuado del lecanemab se aplicaron a una muestra representativa del mundo real de 2126 pacientes de siete clínicas de memoria de Suecia, para ver quién sería apto para la terapia antiamiloide.
Resultados:
- Edad media 77,1 años; 50,4% mujeres.
- La media del MMSE fue de 27 puntos.
- El 32% de los pacientes tenían puntuaciones patológicas de Fazekas.
- El 62% tenía DCL y el 24% demencia EA.
- El 17% de los pacientes tomaban anticoagulantes y el 17% antiagregantes plaquetarios.
- De 918 pacientes con mediciones disponibles de biomarcadores del LCR, el 34,3% tenía amiloide-β 42 anormal, el 32,5% tenía tau fosforilada (p)-anormal, el 50,4% tenía tau total anormal y el 20,6% tenía neurofilamentos ligeros anormales.
- Los perfiles de NTA de 774 de los pacientes eran:
| A-T-N- | A–T–N+ | A+T–N+ | A–T+N– | A+T–N– | A–T+N+ | A+T+N– | A+T+N+ |
|---|---|---|---|---|---|---|---|
| 26.1% | 18.5% | 11.8% | 10.7% | 9.6% | 9.3% | 7.0% | 7.1% |
A: LCR amiloide-β 42; T: LCR p-tau181, N: atrofia del lóbulo temporal medial Los perfiles resaltados son los elegibles para el tratamiento antiamiloide.
- Basándose en los criterios de inclusión y exclusión recomendados, 86 individuos fueron elegibles para la terapia antiamiloide: el 9,4% de los pacientes elegibles para LCR y el 4,1% del total de pacientes.
- Estos pacientes constituían el 10% de los pacientes con DCL (total 64%) y el 25% de los que padecían demencia EA (total 36%).
“En general, [una] proporción relativamente baja de pacientes sería potencialmente elegible”, dijo Matton. “Los enfoques de cribado más amplios, incluidos los biomarcadores sanguíneos de la EA, podrían aumentar potencialmente las cifras”.
Experiencia de un año sobre el uso de lecanemab en la práctica clínica (Resumen: LBS2) Tratamiento con lecanemab en entornos reales en Estados Unidos (Presentación 1)
Presentador: Marwan Sabbagh
- Datos evaluados de la base de datos de investigación Komodo de 3155 pacientes que iniciaron el tratamiento con lecanemab (predominantemente desde octubre de 2023) y tenían una media de 129 días de seguimiento e información sobre la actividad clínica 12 meses antes del tratamiento.
Resultados
- Los pacientes tenían una edad media de 75 años, el 84,3% eran blancos, el 93,3% procedían de zonas urbanas y el 55,8% eran mujeres.
- La mayoría tenía enfermedades comórbidas, principalmente dislipidemia (54,4%) e hipertensión (45,7%).
- El 60,8% tenía DCL y el 83,8% EA.
- El 67,6% tomaba medicamentos orales antiAD (inhibidores de la acetilcolinesterasa o memantina), el 3,7% tomaba anticoagulantes y el 4,1% antiagregantes plaquetarios.
- El tiempo medio desde el diagnóstico hasta el inicio del tratamiento fue de 4,9 meses.
- Los pacientes recibieron una media de dos infusiones mensuales con 16,5 días de diferencia y la primera RM se realizó una media de 46,7 días después del inicio del tratamiento.
- La tasa de adherencia -no más de 90 días entre dos infusiones- fue del 85,1%.
Los pacientes recibían el lecanemab “según la etiqueta y a tiempo”, dijo Sabbagh. Están “muy motivados para seguir con el lecanemab una vez que comprenden las consecuencias del tratamiento y del no tratamiento.”
Uso de lecanemab en la práctica clínica de un centro médico académico (Presentación 2)
Presentador: Lawrence Honig
- Experiencia del tratamiento de 162 pacientes con lecanemab en el centro médico académico Irvine de Nueva York, EE.UU.
Resultados
- Los pacientes tenían una edad media de 73 años; el 90% eran blancos; el 56% eran mujeres.
- Las afecciones comórbidas eran frecuentes, incluidos los accidentes cerebrovasculares y las hemorragias en un 2% y las malformaciones vasculares en un 3%.
- Evidencia de DCL o demencia EA confirmada por biomarcadores del LCR en el 86%, por PET en el 26%, y por ambos en el 12%.
- El 2% de los pacientes llevaban marcapasos y el 1% tomaban anticoagulantes.
- La puntuación media del MMSE fue de 23,6 puntos, con un rango de 11 a 30 puntos.
- El genotipado de la ApoE se llevó a cabo en el 89%, mientras que el 11% restante se negó.
- Se discutió el riesgo con todos los pacientes, y sólo se excluyó a los que presentaban más de cuatro microhemorragias en la RM previa al tratamiento.
- Se recibió una media de 13,1 infusiones durante un periodo de 18 meses y se realizaron hasta cuatro resonancias magnéticas tras el tratamiento.
- Se realizaron nueve resonancias magnéticas no programadas por sospecha de ARIA, una de las cuales fue positiva.
- Las tasas de edema/efusión ARIA (ARIA-E) y microhemorragia ARIA (ARIA-H) fueron del 11% y el 5%, respectivamente.
- La ARIA-E solía aparecer pronto, era mayoritariamente asintomática y se resolvía en unos meses al reanudar la dosis de lecanemab.
- El tratamiento se interrumpió en el 9% de los pacientes, predominantemente debido a la ARIA-E.
- 16 de los 17 casos de ARIA-E eran asintomáticos.
- El 8% de los pacientes interrumpieron el tratamiento: uno con ARIA-E, dos con ARIA-H y uno tanto con ARIA-E como con ARIA-H que falleció posteriormente, así como ocho debido a la carga, desinterés, problemas con el seguro o falta de beneficios, y cuatro que se perdieron durante el seguimiento debido al traslado.
La experiencia clínica con lecanemab “no fue distinta de la de los ensayos clínicos”, dijo Honig. Fue “segura y manejable” , con “amplia aceptación y cumplimiento por parte de los pacientes”.
ARIA
Puntos clave:
- La titulación de la dosis de donanemab podría ayudar a reducir las tasas de ARIA-E.
- La unión “fuera del objetivo” de las terapias antiamiloides a la angiopatía amiloide cerebral en lugar de a la placa amiloide puede no explicar las diferencias en las tasas de ARIA-E.
- La IA podría ayudar a que la codificación de acontecimientos adversos fuera más eficaz para los médicos.
- La variabilidad de las medidas de RM ultrarrápida no es mayor que la de las exploraciones estándar.
El efecto de diferentes regímenes de dosificación de donanemab en la disminución de ARIA-E y amiloide en adultos con enfermedad de Alzheimer sintomática temprana: resultados primarios de TRAILBLAZER-ALZ 6 (Resumen: OC01)
Presentador: John Sims (EEUU)
- El estudio de fase 3b analizó si la modificación del régimen de dosificación de donanemab podía reducir las tasas de ARIA-E en 843 pacientes con EA.
–
–
Titulación estándar: donanemab intravenoso cada 4 semanas a una dosis de 700 mg para las tres primeras infusiones y luego a 1400 mg para la cuarta.
Régimen de titulación modificado – donanemab intravenoso 350 mg para la primera infusión, 700 mg para la segunda infusión, 1050 mg para la tercera infusión y 1400 mg para la cuarta infusión.
Resultados
- En la semana 24, los pacientes del brazo de valoración modificada tenían una tasa significativamente menor de ARIA-E que los del brazo de valoración estándar, un 13,7% frente a un 23,7%.
- Había un 94% de probabilidades de conseguir al menos una reducción del 20% en las tasas de ARIA-E con la titulación modificada, lo que cumplía el objetivo primario del estudio de más del 80%.
- En la RM a las 24 semanas, el 86% de los pacientes del grupo de titulación modificada estaban libres de ARIA-E, en comparación con el 76% de los del grupo de titulación estándar.
- No hubo diferencias entre los dos regímenes de titulación en cuanto a otros acontecimientos adversos graves o interrupciones del tratamiento o acontecimientos adversos relacionados con el tratamiento.
- Hubo una muerte en un paciente con ARIA-E en curso en el grupo de titulación modificada debido a una hemorragia intraparenquimatosa cerebral
- La disminución del amiloide fue comparable con los regímenes de titulación modificado y estándar (disminuciones medias respecto al valor basal de 56,3 y 58,8 centiloides, respectivamente).
Los resultados sugieren que “un enfoque de titulación mejorada puede limitar el riesgo de ARIA manteniendo una reducción suficiente del amiloide”.
La preferencia de los anticuerpos antiamiloides por los agregados vasculares de Aβ no explica las tasas de ARIA (Resumen: OC35)
Presentador: Andrew Stern
- Se comprobó la afinidad con la que el aducanumab, el donanemab y el lecanemab se unen a la angiopatía amiloide cerebral “fuera del objetivo” en relación con la placa amiloide “en el objetivo”, como posible explicación de las diferentes tasas de anomalías en las imágenes relacionadas con el amiloide con edema y/o derrame (ARIA-E) entre las terapias.
Resultados
- Tasas ARIA-E comunicadas anteriormente:
- 35,2% para el aducanumab (*2,8 veces la diferencia)
- 24,0% para donanemab
- 12,6% para el lecanemab (*2,8 veces la diferencia)

- La unión preferente de los anticuerpos sintetizados a partir de secuencias de aminoácidos al amiloide-β 40 meníngeo, que está enriquecido en CAA, y al amiloide-β42 parenquimatoso, que está enriquecido en placas, se incrementó en una media:
- 1,51 veces con aducanumab
- 1,63 veces con donanemab
- 1,85 veces con lecanemab
- No hubo diferencias significativas entre las tres terapias, y la unión preferente de 0,83 a 1,8 veces con aducanumab no explica la diferencia de 2,8 veces en la tasa de ARIA-E en comparación con lecanemab.
Stern concluyó que “la preferencia de los anticuerpos por los agregados meníngeos ricos en amiloide-β 40 frente a los agregados parenquimatosos ricos en amiloide-β 42 no puede explicar las diferencias en las tasas de ARIA”.
Supervisión de la seguridad mediante inteligencia artificial en los ensayos clínicos de la enfermedad de Alzheimer (Resumen: OC36)
Presentador: Gustavo Jiménez-Maggiora (EEUU)
- Se evaluó el uso del procesamiento del lenguaje natural y la inteligencia artificial (IA) para aumentar la codificación basada en el clínico de 980 acontecimientos adversos utilizando datos recogidos de ocho ensayos completados de pacientes sintomáticos con EA.
Resultados
- La IA superó a la codificación tradicional basada en el clínico en general (precisión del 88 frente al 71%) y en toda la gama de frecuencias de los códigos, y mejoró la precisión en el nivel de notificación (tras la revisión clínica experta y el análisis bioestadístico) en un 3-13%.
- En una cohorte separada (Estudio A4) de pacientes preAD, la codificación de la IA fue comparable a la de la codificación basada en el médico, en torno al 70%, pero aumentó la precisión en el nivel de notificación en un 3-5%.
- La codificación EA basada en IA fue más rentable, con una reducción de costes de aproximadamente el 80%.
“La codificación basada en la inteligencia artificial puede realizarse instantáneamente sin pérdida de precisión en relación con la codificación del clínico, lo que reduce los costes y mejora la disponibilidad de los datos de seguridad”, afirma Jiménez-Maggiora.
Un protocolo de IRM ultrarrápida para ayudar al diagnóstico y tratamiento de la enfermedad de Alzheimer (Resumen: OC34)
Presentador: Miguel Rosa-Grilo (Reino Unido)
- Se comparó la variabilidad de tres neurólogos que interpretaban una exploración de imagen rápida mediante imagen paralela avanzada controlada por ondas con una exploración de resonancia magnética (RM) clínica estándar (exploraciones rápidas frente a estándar) en 90 individuos: El 41,1% no tenía ninguna enfermedad cerebral neurodegenerativa; el 21,1% tenía EA; el 12,2% tenía degeneración lobar frontotemporal (DLFT); el 8,9% tenía deterioro cognitivo vascular (DCV); y el 16,7% tenía otros diagnósticos.
Resultados
- La exploración rápida reduce el tiempo de adquisición en aproximadamente un 63% respecto a una exploración estándar (6 min 29 seg frente a 17 min 39 seg)
- La variabilidad introducida por la exploración rápida fue menor que la de la exploración estándar, lo que demuestra la no inferioridad entre ambos métodos.
Los coeficientes kappa de fiabilidad entre evaluadores* fueron:
- Normal: Exploración rápida=0,61; exploración estándar=0,65; entre las exploraciones: 0,80
- EA: exploración rápida=0,38; exploración estándar=0,42; entre las exploraciones=0,72
- FTLD: barrido rápido=0,79; barrido estándar=0,71; entre los barridos=0,95
- VCI: barrido rápido=0,75; barrido estándar=0,75; entre los barridos=0,95
- Otros diagnósticos: Exploración rápida=0,48; exploración estándar=0,50; entre las exploraciones=0,76
* 0,21-0,40= regular; 0,41-0,60= moderado; 0,61-0,80= sustancial
“Se necesitan más estudios para evaluar el ahorro real de tiempo en la práctica y las implantaciones ultrarrápidas en diferentes intensidades de campo”, afirma Rosa-Grilo.
Haz clic abajo para descargar el pdf del Microdigesto 3 del CTAD:
Download Microdigest 3 ES PDFTambién puedes descargar el Microdigest 2 pdf de la AAIC:
Download Microdigest 2 ES PDFTambién puedes descargar el Microdigesto de AD/PD & CONy:
Download Microdigest 1 ES PDF





