Microdigesto 2
Resumen de AAIC
Aquí resumimos los principales datos publicados en la AAIC 2024, centrados en nuevos biomarcadores y terapias antiamiloides.
Plasma Biomarcadores
Puntos clave:
Posibles aplicaciones clínicas:
- Cribado clínico y selección de pacientes para el tratamiento.
- Estadificación de la enfermedad.
- Seguimiento de la respuesta al tratamiento.
Consideraciones:
- El impacto potencial de comorbilidades como la enfermedad renal crónica.
- La influencia de las diferencias raciales en los niveles y puntos de corte mediante ensayos.
- La necesidad de normalizar los ensayos clínicamente relevantes.
- Cuándo hacer la prueba.
Evaluación del uso prospectivo de biomarcadores sanguíneos para la enfermedad de Alzheimer en atención primaria y secundaria (ID del resumen: 88404)
Presentador: Oskar Hansson (Suecia)
Biomarcadores plasmáticos analizados:
- Puntuación de probabilidad de amiloide (PPA)2: cociente amiloide-β plasmático 42/40 + cociente plasma fosforilado (p)-tau217/no p-tau217.
- Relación p-tau217/no p-tau217 plasmática sola.
Results:
- La relación p-tau217 plasmática por sí sola tuvo una precisión comparable a la APS2.
- La precisión diagnóstica de ambos biomarcadores plasmáticos ronda entre el 89% y el 92% en entornos de atención primaria y secundaria, en análisis de lote único y prospectivos, al utilizar umbrales de corte únicos y dobles, y para la patología amiloide del líquido cefalorraquídeo (LCR), así como para la EA clínica.
- Los respectivos valores predictivos positivo y negativo (VPP y VPN) oscilaron entre el 86% y el 92% y entre el 90% y el 97%.
- Los biomarcadores sanguíneos mejoraron significativamente el diagnóstico estándar realizado por los médicos de atención primaria y los especialistas en demencia.
- Tasas bajas de pacientes “intermedios” basadas en el doble umbral de 95% de especificidad (alto riesgo) y 95% de sensibilidad (bajo riesgo): atención primaria 4-13% y atención secundaria 6-11%.
Utilidad de los biomarcadores plasmáticos en la detección del amiloide cerebral en el Centro de Investigación de la Enfermedad de Alzheimer de 1Florida (ADRC) (ID del resumen: 91578)
Presentador: Ranjan Duara (EEUU)
- Etnia/raza de los participantes: 56% hispanos y 96% blancos; 3% negros; 1% otros.
- Biomarcadores sanguíneos analizados: relación amiloide-β 42/40; p-tau217; proteína ácida fibrilar glial (GFAP); y luz de neurofilamentos (NfL).
- Una combinación de biomarcadores, genotipo APOE y atrofia del hipocampo predijo la tomografía por emisión de positrones (TEP) amiloide positiva con “alta precisión”, en modelos de regresión logística, utilizando el punto de corte de sensibilidad y especificidad del índice de Youden y teniendo en cuenta la edad y el sexo.
- El p-tau217 obtuvo los mejores resultados como biomarcador plasmático independiente.
| AUC | Sensitivity | Specificity | |
|---|---|---|---|
| APOE ε4+, hippocampal atrophy+ (base) | 0.78 | 71% | 76% |
| Base plus all plasma biomarkers | 0.96 | 93% | 87% |
| Base plus amyloid-β 42/40 ratio | 0.88 | 80% | 82% |
| Base plus p-tau217 | 0.94 | 92% | 84% |
| p-tau217 | 0.92 | 85% | 89% |
| Amyloid-β 42/40 ratio | 0.82 | 77% | 81% |
| Amyloid-β 42/40 ratio plus p-tau217 | 0.94 | 93% | 85% |
Abreviaturas: AUC, área bajo la curva receiver operating characteristic; APOE, apolipoproteína E.
Uso del p-tau217 plasmático como método de preselección para detectar la positividad de la PET-amiloide en participantes sin deterioro cognitivo: Un estudio multicéntrico (ID del resumen: 85773)
Presentadora: Gemma Salvadό (Suecia)
- Puntos de corte: especificidad 90,0%, 95,0%, 97,5%.
- Resultados tras ajustar por edad y estado APOE:
| p-tau217 only | Subsequent CSF amyloid-β 42/40 in patients positive for p-tau217 | |
|---|---|---|
| Positive predictive value | 72.9–81.2% | 90.8–95.3% ↑ |
| Negative predictive value | 82.5–86.2% | 82.8–86.7% |
| Accuracy | 82.4–83.8% | 84.0–87.3% ↑ |
| Overall rate of amyloid positivity | 10.9–18.1% | 9.3–14.3% ↓ |
| Probability of being assessed as positive on both p-tau217 and CSF | '- | 79.4–85.2% |
- “El p-tau217 plasmático podría utilizarse, bien como biomarcador autónomo, bien como paso inicial antes de los biomarcadores del LCR (reduciendo su necesidad en un ~80-90%), para la preselección en ensayos clínicos de EA preclínica en función de la certeza necesaria para la positividad de Aβ-PET”, afirmó Salvadό.
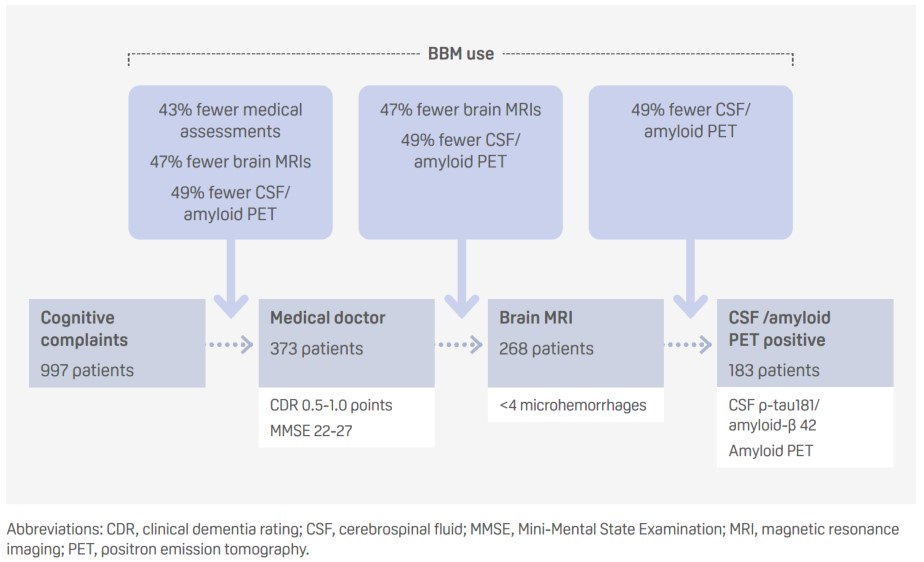
Utilización de un panel de biomarcadores sanguíneos de la enfermedad de Alzheimer para determinar la elegibilidad para un tratamiento modificador de la enfermedad en un entorno clínico de la memoria: tres escenarios (ID del resumen: 91700)
Presentador: Sinthujah Vigneswaran (Países Bajos)
- El uso de biomarcadores sanguíneos (BBM) en distintas fases de la trayectoria diagnóstica estándar podría aumentar la eficacia del proceso, negando la necesidad de pruebas adicionales y reduciendo así los costes.
- El p-tau217 detectó la positividad amiloide, basándose en un punto de corte del índice de Youden con una especificidad del 92%, con una sensibilidad del 86%, una especificidad del 87% y con unas tasas de falsos positivos y negativos del 7% y el 32%, respectivamente.
Evaluación de la intercambiabilidad de biomarcadores sanguíneos y amiloide-PET para identificar a pacientes con patología de Alzheimer (ID del resumen: 91465)
Presentadora: Samantha Burnham (EEUU)
Biomarcadores plasmáticos analizados:
- PrecivityAD®, que combina los niveles de amiloide-β42/40, APOE ε4 y edad.
- p-tau217.
Estratificación del plasma:
- Amiloide-β42/40: ausencia de placas amiloides, presencia de placas amiloides o intermedio.
- p-tau217: negativo, positivo o indeterminado.
Resultados tras descartar un 14,0% de pacientes intermedios en PrecivityAD® y un 18,6% en p-tau217:
| PrecivityAD® | p-tau217 | |
|---|---|---|
| Ruling in patients also amyloid PET visual read positive (PPV) | 86% | 88% |
| Ruling out patients also amyloid PET visual read negative (NPV) | 78% | 92% ↑ |
| Overall percentage agreement with amyloid PET visual read | 81% | 90% ↑ |
- Ambos biomarcadores plasmáticos cumplían los criterios de no inferioridad respecto a la PET amiloide con un punto de corte de 37 centiloides (CL) para seleccionar a los pacientes con patología amiloide.
- “Los resultados apoyan la hipótesis de que los biomarcadores sanguíneos pueden ser intercambiables con los criterios de la PET-amiloide para seleccionar a los pacientes que son aptos para el tratamiento con nuevas terapias dirigidas al amiloide y que se beneficiarían de él”, afirma Burnham.
Análisis de sangre para la enfermedad de Alzheimer de los cocientes amiloide-beta 42/40, %p-tau217, 181 y 205 y MTBR-243 en poblaciones del mundo real: Resultados de SEABIRD y BioFINDER2 (ID del resumen: 88405)
Presentador: Randall Bateman (EEUU)
- La región plasmática de unión a microtúbulos (MTBR)-tau243 muestra una buena precisión diagnóstica para la positividad de la PET-tau y una correlación sólida con la PET-tau en las regiones tardías de Braak, que es consistente en pacientes con y sin positividad de amiloide-β.
| All participants n=108 | Amyloid-β-positive participants n=51 | |
|---|---|---|
| MTBR-tau243 | 1.00 | 0.98 |
| p-tau217/tau217 ratio | 0.98 | 0.87 |
| p-tau217 concentration | 0.98 | 0.89 |
| All participants n=108 | Amyloid-β-positive participants n=51 | |
|---|---|---|
| Braak I–VI (Global) | 0.87 | 0.86 |
| Braak I–II | 0.89 | 0.54 |
| Braak III–IV | 0.89 | 0.79 |
| Braak V–VI | 0.85 | 0.86 |
AUC: área bajo la curva característica de funcionamiento del receptor
- Se observó que la correlación con la puntuación del Mini-Mental State Examination (MMSE) era similar para el MTBR-tau243 que para el PET de tau en todos los pacientes (Rho=-0,82 frente a -0,69) y en aquellos con placas amiloides (Rho=-0,54 frente a -0,53).
Evaluación comparativa de los principales análisis de sangre para detectar la patología amiloide (ID del resumen: 95506)
Presentador: Kellen Petersen (EEUU)
Modelos de regresión logística que predicen la exactitud de los biomarcadores sanguíneos para predecir la positividad de la PET-amiloide (>20 CL) mediante el análisis AUC y se comparan mediante las pruebas de DeLong.
| Platform | Model | AUC |
|---|---|---|
| C2N Precivity™ | p-tau217 ratio* plus amyloid-β 42/40 | 0.929 ★ |
| p-tau217 ratio | 0.927 | |
| p-tau217 plus amyloid-β 42/40 | 0.921 | |
| p-tau217 | 0.916 | |
| amyloid-β 42/40 | 0.751 | |
| Fujirebio Lumipulse® | p-tau217 plus amyloid-β 42/40 | 0.911 |
| ptau217 | 0.896 | |
| amyloid-β 42/40 | 0.787 | |
| AlzPath Simoa® | p-tau217 | 0.885 |
| Janssen Simoa® | p-tau217 | 0.882 |
| Roche Elecsys® | p-tau181 plus amyloid-β 42/40 plus GFAP plus NfL | 0.677 to 0.873 |
| p-tau181 plus amyloid-β 42/40 plus NfL | 0.677 to 0.873 | |
| p-tau181 plus amyloid-β 42/40 | 0.677 to 0.873 | |
| p-tau181 | 0.677 to 0.873 | |
| amyloid-β 42/40 | 0.677 to 0.873 | |
| GFAP | 0.677 to 0.873 | |
| NfL | 0.677 to 0.873 | |
| Quanterix Simoa® | p-tau181 plus amyloid-β 42/40 plus GFAP plus NfL | 0.670 to 0.808 |
| p-tau181 plus amyloid-β 42/40 plus NfL | 0.670 to 0.808 | |
| p-tau181 plus amyloid-β 42/40 | 0.670 to 0.808 | |
| p-tau181 | 0.670 to 0.808 | |
| amyloid-β 42/40 | 0.670 to 0.808 | |
| GFAP | 0.670 to 0.808 | |
| NfL | 0.670 to 0.808 |
AUC: área bajo la curva receiver operating characteristic; GFAP: proteína ácida fibrilar glial; NfL: neurofilamento ligero
*p-tau217 relación entre p-tau217 y no-p-tau217
Comparación directa entre la p-tau217 plasmática y la tau-PET para predecir el deterioro cognitivo futuro en personas sin deterioro cognitivo (ID del resumen: 90966)
Presentador: Rik Ossenkoppele (Países Bajos; Suecia)
La p-tau217 plasmática predice el deterioro cognitivo en el miniexamen del estado mental (MMSE) y en el Compuesto Cognitivo Preclínico de Alzheimer modificado (mPACC).
Mejores modelos predictivos:
- MMSE: plasma p-tau217 más captación tau-PET en el neocórtex temporal (neoT; medido con menos de un año de diferencia).
- mPACC: captación plasmática de p-tau217 más tau-PET en el lóbulo temporal medial (MTL; medido con menos de un año de diferencia).
| Cognitive decline on MMSE | Cognitive decline on mPACC | |
|---|---|---|
| Plasma p-tau217 | R2 = 0.14 | R2 = 0.30 |
| MTL tau-PET | R2 = 0.17 | R2 = 0.32 |
| NeoT tau-PET | R2 = 0.21 | R2 = 0.31 |
Biomarcadores plasmáticos de Tau para la estadificación de la enfermedad de Alzheimer (ID del resumen: 88408)
Presentadora: Laia Montoliu-Gaya (Suecia)
- Modelo de estadificación de la enfermedad en cinco pasos propuesto a partir de la positividad de cuatro péptidos tau plasmáticos (p-tau217, p-tau205, 0N específico del SNC y tau 212-221) tras la cuantificación de seis péptidos tau fosforilados y seis no fosforilados en 553 muestras plasmáticas de participantes en la cohorte BioFINDER-2.
- El modelo se comparó con el estado de la PET de amiloide (A) y tau (T) y los estadios de la PET en el lóbulo temporal medial temprano (MTL) y la región neotemporal intermedia (neoT).
| Plasma stage | A/T status | A- T- | A+ T- | A+ T+ | PET stage | MTL+ neoT– | MTL+ neoT+ | MTL+ neoT++ | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Plasma Stage | A/T Status | PET stage | ||||||||||||
| A- T- | A+ T- | A+ T- | MTL+ neoT- | MTL+ neoT+ | MTL+ neoT++ | |||||||||
| Stage 1: negative for all biomarkers | 80.8% | 19.2% | '- | '- | '- | '- | ||||||||
| Stage 2: p-tau217 positive | 3.4% | 40.9% | 55.7% | 22.6% | 22.6% | 31.0% | ||||||||
| Stage 3–4: p-tau217, p-tau205, and 0N CNS-specific positive | '- | '- | 100% | '- | 83.3-86.7% | |||||||||
| Stage 5: p-tau 217, p-tau205, 0N CNS- specific, and tau 212–221 positive | '- | '- | 100% | '- | '- | 100% | ||||||||
- “Nuestros datos apoyan la idea de estadificar la EA mediante biomarcadores de fluidos”, afirma Montoliu-Gaya.
Predicción de los estadios de la patología amiloide y tau mediante PET con biomarcadores plasmáticos en la enfermedad de Alzheimer (ID del resumen: 90581)
Presentador: Han-Kyeol Kim (República de Corea del Sur)
La relación entre la p-tau217 y la no-tau217 plasmática fue superior a la p-tau217 y a la relación entre el amiloide-β 42 y el amiloide-β 40 para predecir la fase de Thal y el estadio de Braak medidos mediante PET, sobre todo en los estadios iniciales.
Las AUC para la relación p-tau217/no p-tau217 en plasma fueron:
- 0,965 para predecir la fase I-II de Thal
- 0,848 para predecir la fase Thal ≥III
- 0,864 para predecir Braak I-II
- 0,925 para predecir Braak III-IV
- 0,889 para predecir Braak V-VI
Cambios de mediana a avanzada edad en los biomarcadores sanguíneos de la patología y la neurodegeneración de la enfermedad de Alzheimer y asociaciones con el depósito amiloide cerebral: El estudio ARIC-PET (ID del resumen: 91307)
Presentadora: Priya Palta (EEUU)
Los biomarcadores plasmáticos se midieron en la mediana edad, a una edad media de 58,5 años, o más tarde, a una edad media de 76,2 años.
Biomarcadores analizados:
- Relación entre amiloide-β 42 y amiloide-β 40
- Fosforilado (p)-tau181
- Luz de neurofilamentos (NfL)
- Proteína ácida fibrilar glial (GFAP)
Biomarcadores plasmáticos en la mediana edad: Ninguno de los biomarcadores medidos en la mediana edad predijo la positividad amiloide en la PET de la mediana edad, definida como un cociente de valor de captación estandarizado global de la corteza superior a 1,2, una mediana de 19,3 años más tarde.
Biomarcadores plasmáticos tardíos: Asociaciones significativas con la positividad amiloide de la PET en la vida tardía cuando se midió una mediana de 1,6 años antes para:
- Proporción amiloide-β 40/42: odds ratio=2,12
- p-tau181: odds ratio=1,76
- GFAP: odds ratio=1,72
Terapias antiamiloides
Puntos clave:
- Se recomienda una dosificación de duración limitada para el donanemab más allá de los 12 meses, que se guía mejor por una PET visualmente negativa que por los niveles de tau.
- Las pruebas, incluidos los datos de biomarcadores, apoyan el uso precoz de lecanemab y el beneficio continuado durante 3 años.
Perspectivas del TRAILBLAZER-ALZ 2 (Donanemab): Traducción clínica potencial (Sesión temática en desarrollo)
Eficacia clínica
Presentadora: Jennifer Zimmer (EEUU)
- A las 76 semanas, el donanemab había reducido el riesgo de progresión de la enfermedad al siguiente estadio de la enfermedad de Alzheimer (EA) en la Clinical Dementia Rating Global Score (CDR-GS; medida cada 3 meses) en un significativo 37%.
- El porcentaje de pacientes que evolucionaron a EA moderada (puntuación CDR-GS ≥2 puntos) a las 76 semanas se redujo en un 50% significativo.
- La eficacia fue consistente en todas las poblaciones de tau: el riesgo de progresión de la enfermedad entre los pacientes con tau baja-media y alta se redujo en un significativo 39% y 38%, respectivamente.
- Eficacia consistente en todos los subgrupos, incluidos los participantes hispanos/latinos.
Riesgo ARIA controlable
Presentador: Alessandro Biffi (EEUU)
- En el 24% de los pacientes que tomaban donanemab se produjeron anomalías en las imágenes relacionadas con el amiloide -edema/efusiones (ARIA-E)-, el 18% asintomáticas y el 6% sintomáticas.
- Se produjeron acontecimientos ARIA-E graves en el 1,5% de los pacientes tratados con donanemab, con resultado de muerte en tres (0,4%) pacientes.
- Mayor frecuencia de ARIA-E en los homocigotos de la apolipoproteína (APO)E ε4 (40,6 frente al 15,7% de los no portadores).
- La mayoría de los pacientes sólo tuvieron un episodio de ARIA-E; al 68% de los pacientes se les volvió a administrar la dosis, sin recidiva en el 70%.
- Las recidivas de ARIA-E solían ser asintomáticas y de leves a moderadas.
- Los principales factores de riesgo son:
- Genotipo APOE ε4.
- Número de microhemorragias basales.
- Presencia de siderosis cortical superficial al inicio del estudio.
- Recomendaciones para la gestión de riesgos:
- Identificar a los pacientes de mayor riesgo antes del tratamiento.
- Cumplir el programa de seguimiento de la resonancia magnética.
- Titula, interrumpe o suspende el tratamiento según sea necesario.
- Utiliza corticoesteroides en caso de ARIA grave o sintomática.
Dosificación de duración limitada
Presentadora: Emily Collins (EEUU)
- Los niveles de amiloide se mantuvieron bajos entre los pacientes que cumplieron los criterios de finalización de la dosis, con una tasa de reacumulación de 2,8 centiloides (CL)/año.
- El tiempo medio hasta el cambio a placebo fue de 47 semanas y la diferencia entre los grupos de tratamiento siguió aumentando más allá de este punto.
- Dos tercios de los pacientes tenían niveles de PET amiloide inferiores a 24,1 CL a los 12 meses y esto era coherente con una PET visualmente negativa, que podía utilizarse para ayudar a determinar cuándo interrumpir el tratamiento.
- Los niveles basales más bajos de amiloide predijeron una reducción más temprana de la TEP de amiloide por debajo de 24,1 CL.
- La p-tau plasmática no era lo bastante precisa para determinar la eliminación del amiloide con donanemab, porque tras la eliminación del amiloide sigue reflejando la patología de la tau.
¿Existen pruebas de que el tratamiento a largo plazo con lecanemab siga siendo beneficioso? Una actualización de beneficios/riesgos a partir de datos de eficacia, seguridad y biomarcadores a largo plazo (ID del resumen: 92094)
Presentador: Christopher Van Dyck (EEUU)
Pruebas del efecto continuado del tratamiento con lecanemab durante 3 años:
- A los 36 meses, el cambio medio en la Clasificación de la Demencia Clínica-suma de casillas (CDR-SB) desde el inicio fue de 3,09 puntos, en comparación con un cambio medio de 1,20 puntos a los 18 meses.
- Esto se tradujo en una diferencia significativa de 0,95 puntos en la CDR-SB en comparación con los controles históricos emparejados del estudio ADNI, un aumento de la diferencia de 0,45 puntos en comparación con el placebo a los 18 meses, y una reducción del 30% del riesgo de progresión al siguiente estadio de la enfermedad.
Los grupos de tau y amiloide bajos obtienen resultados especialmente buenos, lo que respalda el uso precoz de lecanemab:
- Entre los 58 pacientes sin TEP de tau o con una TEP de tau baja (SUVR <1,06) al inicio del estudio, el 59% no experimentó ningún descenso en la puntuación CDR-SB a los 36 meses, y el 51% experimentó una mejoría.
- Entre los 151 pacientes con una TEP amiloide baja al inicio del estudio (<60 CL), el 46% no experimentó ningún descenso en la puntuación CDR-SB y el 33% experimentó una mejoría.
Los datos de biomarcadores plasmáticos apoyan el uso continuado de lecanemab:
- Mejora de la TEP amiloide y del cociente amiloide-β 42/40 en plasma en un plazo de 3 meses entre los pacientes que empezaron a tomar lecanemab a los 18 meses.
- Beneficio continuado del tratamiento de 18 a 36 meses, a pesar de que aproximadamente el 70% de los pacientes eran amiloides negativos (<30 CL) a los 18 meses.
- Los niveles plasmáticos de p-tau217 disminuyen en los primeros 18 meses con el tratamiento con lecanemab, pero aumentan con el placebo.
- El MTBR-tau243 del LCR disminuyó un 44% tras 18 meses de tratamiento con lecanemab frente a placebo.
Bajo riesgo de ARIA a largo plazo
- La tasa ajustada a la exposición de anomalías en las imágenes relacionadas con el amiloide -edema/efusiones (ARIA-E)- fue de 6,8 por 100 personas-año con lecanemab en el estudio principal y la fase de extensión, en comparación con 9,6 por 100 personas-año sólo en el estudio principal.
- La ARIA-E se produce principalmente en los primeros 6 meses de tratamiento, tras los cuales hay pocos casos y las tasas son similares a las del placebo.
- Los ARIA no se asocian a una progresión acelerada a largo plazo.
¿Cómo respaldan los últimos datos y modelos de farmacología clínica la dosificación continuada de lecanemab? (ID de resumen: 92091)
Presentadora: Larisa Reyderman (EEUU)
Estudio 201: 31 pacientes con enfermedad de Alzheimer temprana que dejaron de tomar lecanemab (10 mg/kg cada 2 semanas) tras 18 meses de tratamiento, antes de reanudarlo una media de 2 años después.
- La doble acción del lecanemab significa que no sólo elimina las placas, sino que también se dirige a las protofibrillas altamente tóxicas que siguen formándose y causan la patología de la enfermedad de Alzheimer después de eliminar el amiloide.
La interrupción del lecanemab en el estudio 201 provocó:
- 21% de reacumulación de PET amiloide.
- 47% de empeoramiento de la relación amiloide-β 42/40.
- 30% de reacumulación de proteína ácida fibrilar glial (GFAP).
- 24% de reacumulación de p-tau181.
- 13% de reacumulación de p-tau217.
La modelización farmacocinética y farmacodinámica demostró que se pierde la mitad del efecto terapéutico del lecanemab:
- Después de 6 meses para la relación amiloide-β 42/40.
- En un plazo de 12,1 años para la PET amiloide.
- En 1,6 años para p-tau181.
- En 1,7 años para la GFAP.
La dosis mensual de mantenimiento de lecanemab 10 mg/kg iniciada a los 18 o 24 meses es suficiente para prevenir la reacumulación de amiloide y el empeoramiento de los biomarcadores plasmáticos.
- Tuvo un efecto comparable a la dosificación bisemanal durante 4 años en cuanto al resultado clínico medido por PET amiloide y CDR-SB.
Haz clic abajo para descargar el pdf del Microdigesto 2:
Download Microdigest 2 ES PDFTambién puedes descargar el Microdigesto de AD/PD & CONy:
Download Microdigest 1 ES PDF





